Слайды и текст этой презентации
Слайд 1

Описание слайда:
Химические реакции
Выполнила
Болгова ЕД
преподаватель химии
ГБОУ ГАК с Московское
Слайд 2

Описание слайда:
Аннотация
Данная презентация может быть использована при изучении химии на 1 курсе по программе НПО по при изучении темы «Химические реакции».
В презентации рассматривается классификация химических реакций, протекающих с изменением состава вещества.
Слайд 3

Описание слайда:
Цели и задачи урока
Образовательная
обобщить и систематизировать знания обучающихся о классификации химических реакций
отработать навыки определения типа реакции и составления уравнений химических реакций разных типов
Развивающие
Развитие логического мышления обучающихся
Развивать у будущих производственников умение делать обобщение, выводы
Воспитательная
Продолжить формирование творческого начала обучающихся.
Воспитывать инициативу и самостоятельность в трудовой деятельности.
Слайд 4

Описание слайда:
Содержание
Аннотация
Цели и задачи урока
Типы химических реакций
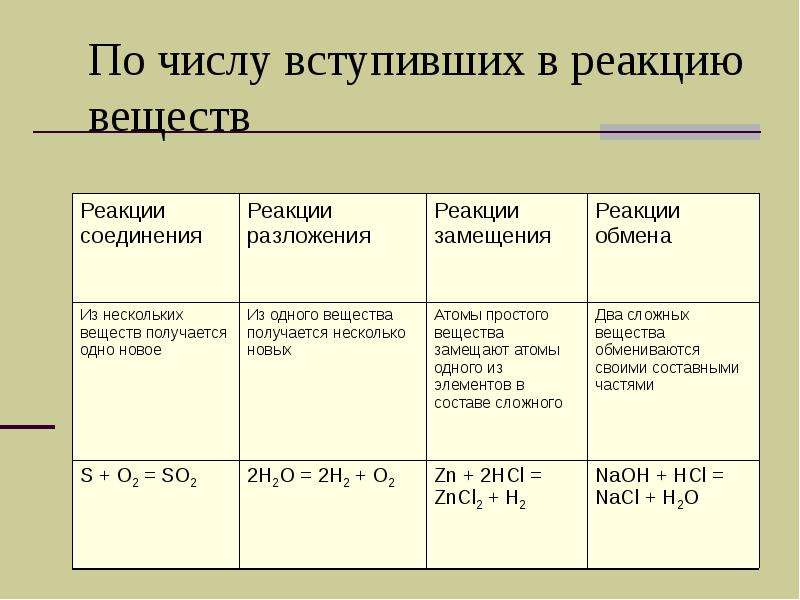
По числу вступивших в реакцию веществ
По числу вступивших в реакцию веществ
Слайд 5

Описание слайда:
Типы химических реакций
По числу вступивших в реакцию веществ
По тепловому эффекту
По обратимости
По изменению степени окисления
По агрегатному состоянию веществ
По механизму
Слайд 6
Описание слайда:
По числу вступивших в реакцию веществ
Слайд 7

Описание слайда:
Правило Бертолле
В растворах электролитов реакции идут до конца в случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, вода)
Слайд 8
Описание слайда:
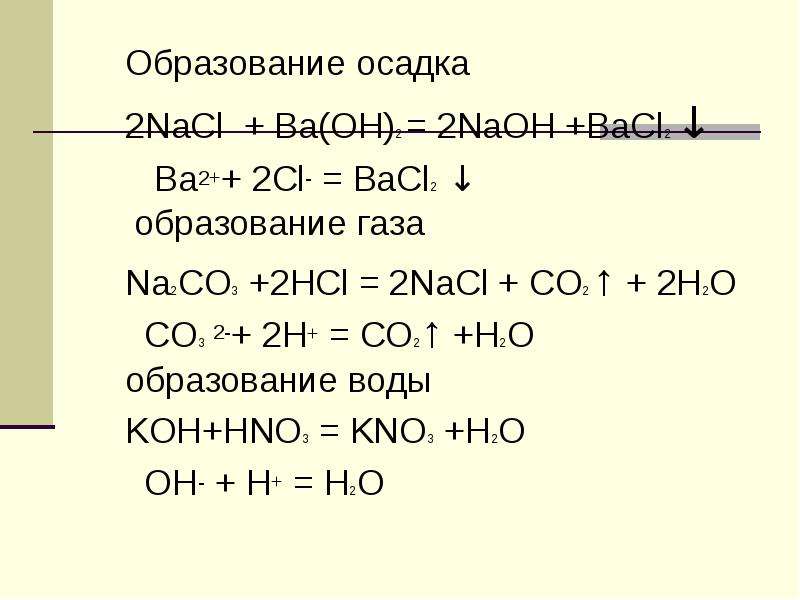
Образование осадка
Образование осадка
2NaCl + Ba(OH)2 = 2NaOH +BaCl2 ↓
Ba2++ 2Cl- = BaCl2 ↓
образование газа
Na2CO3 +2HCl = 2NaCl + CO2 ↑ + 2H2O
CO3 2-+ 2H+ = CO2↑ +H2O
образование воды
KOH+HNO3 = KNO3 +H2O
OH- + H+ = H2O
Слайд 9

Описание слайда:
По тепловому эффекту
Экзотермические -
идут с выделение теплоты
S + O2 = SO2 + Q
Слайд 10

Описание слайда:
По обратимости
Необратимые -
идут только в одном направлении
Условия: образование осадка или слабого электролита (Н2О), выделение газа, выделение большого количества теплоты
Слайд 11

Описание слайда:
По изменению степени окисления
Идут без изменения степени окисления элементов
CaCO3 = CaO + CO2
Слайд 12
Описание слайда:
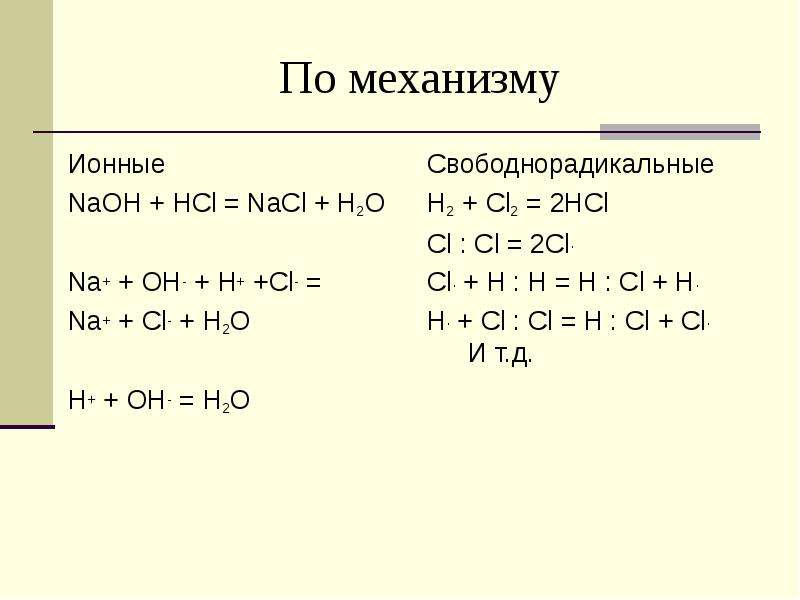
По механизму
Ионные
NaOH + HCl = NaCl + H2O
Na+ + OH- + H+ +Cl- =
Na+ + Cl- + H2O
H+ + OH- = H2O
Слайд 13

Описание слайда:
По агрегатному состоянию веществ
Гомогенные -
между веществами нет поверхности раздела фаз
H2 + Cl2 = 2HCl
Слайд 14

Описание слайда:
Проверь себя
Перепиши схемы химических реакций в тетрадь, расставьте коэффициенты.
Mn(OH)2 MnO + H2O -Q
FeSO4 + BaCI2 BaSO4 + FeCI2
Ba(HCO3)2 BaCO3 + CO2 + H2O
Si + CI2 SiCI4
As2O5 + H2O H3AsO4
P + CI2 PCI3
K2SO4 + AgNO3 Ag2So4 + KNO3
Sn + HCI SnCI2 + H2 +Q
Определите тип химических реакций.
Слайд 15
Описание слайда:
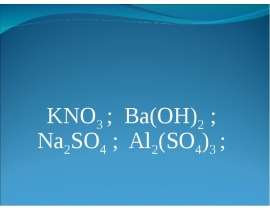
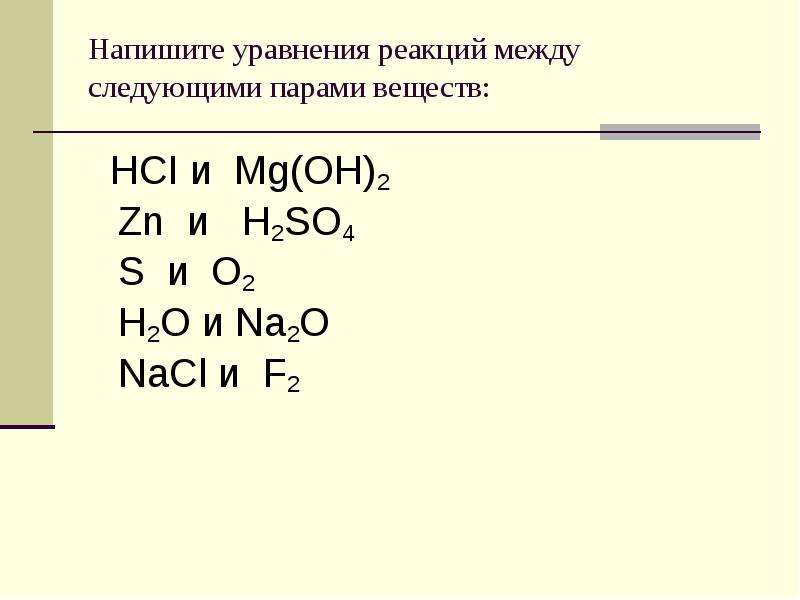
Напишите уравнения реакций между следующими парами веществ:
HCI и Mg(OH)2
Zn и H2SO4
S и O2
H2O и Na2O
NaCl и F2
Слайд 16

Описание слайда:
Вывод
Поставленные цели урока достигнуты
Слайд 17

Описание слайда:
Ресурсы
Литература,
Габриелян О. С. Химия 11кл, М:Дрофа, 2008.
Габриелян О. С. Рунов Н. Н. Химический эксперимент в школе 11кл
Журин А. А. Химические уравнения задания для самостоятельной работы
Интернет ресурсы
http://www.hemi.nsu.ru
http://chemistry.ru
http://www.chem.km.ru/
Презентацию на
тему Химические реакции можно скачать бесплатно ниже: