Слайды и текст этой презентации
Слайд 1

Описание слайда:
Учитель химии МБОУ СОШ №79
г. о. Самара
Язрикова Любовь Михайловна
Слайд 2

Слайд 3

Слайд 4

Описание слайда:
Расстановка степеней окисления
Расстановка степеней окисления
Задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а кто их принимает?
Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция. если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая.
Проверьте, чтобы в реакции был и окислитель, и восстановитель
Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Слайд 5

Описание слайда:
Сначала проставьте коэффициенты, полученные из электронного баланса
Сначала проставьте коэффициенты, полученные из электронного баланса
Если какое-либо вещество выступает и в роли среды, и в роли окислителя (восстановителя) — его надо будет уравнивать позднее, когда почти все коэффициенты расставлены
Предпоследним уравнивается водород
по кислороду мы только проверяем
Слайд 6

Описание слайда:
Расстановка степеней окисления:
Расстановка степеней окисления:
а) степени окисления в водородных соединениях неметаллов: фосфин РН3 — степень окисления у фосфора — отрицательная;
б) в органических веществах — проверьте ещё раз, всё ли окружение атома С учтено
в) аммиак и соли аммония — в них азот всегда имеет степень окисления −3
в) кислородные соли и кислоты хлора — в них хлор может иметь степень окисления +1, +3, +5, +7;
г) двойные оксиды: Fe3O4, Pb3O4 — в них металлы имеют две разные степени окисления, обычно только одна из них участвует в переносе электронов.
Слайд 7

Описание слайда:
2. Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель без восстановителя или наоборот
2. Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель без восстановителя или наоборот
3. Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак;
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.
Слайд 8
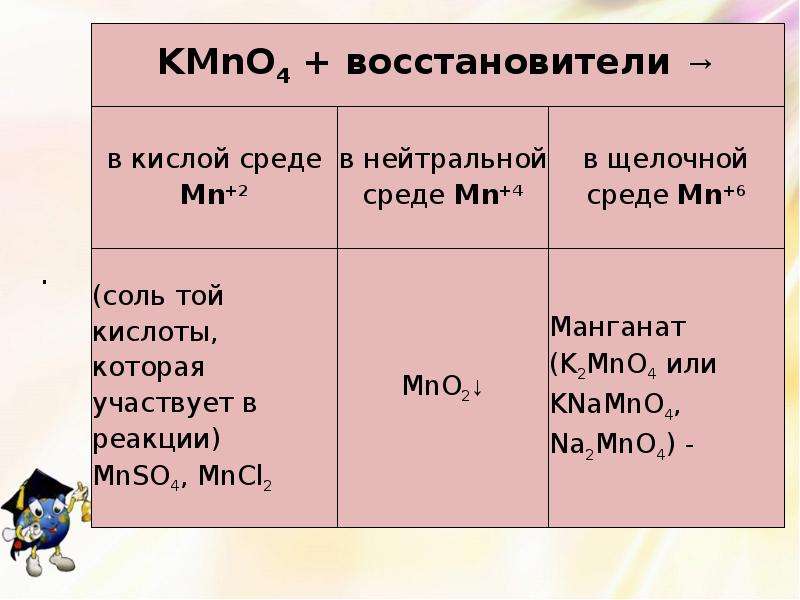
Слайд 9
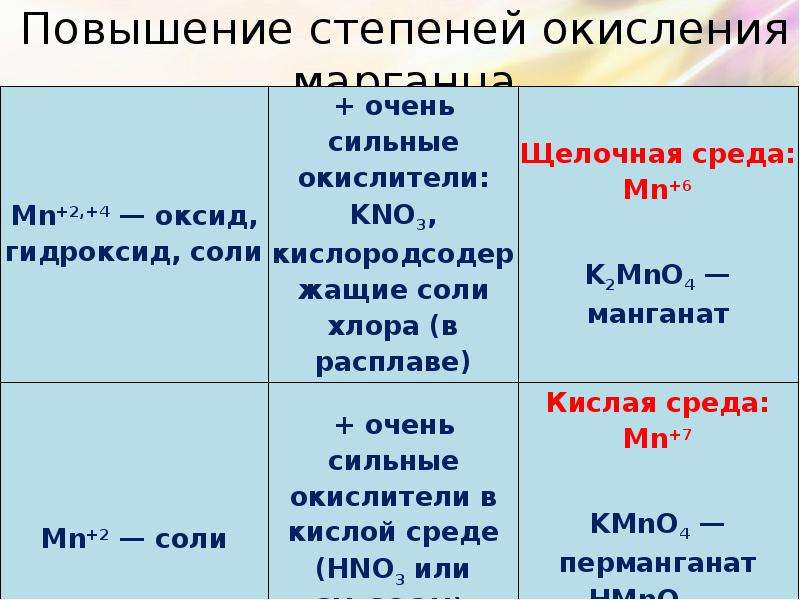
Описание слайда:
Повышение степеней окисления марганца
Слайд 10
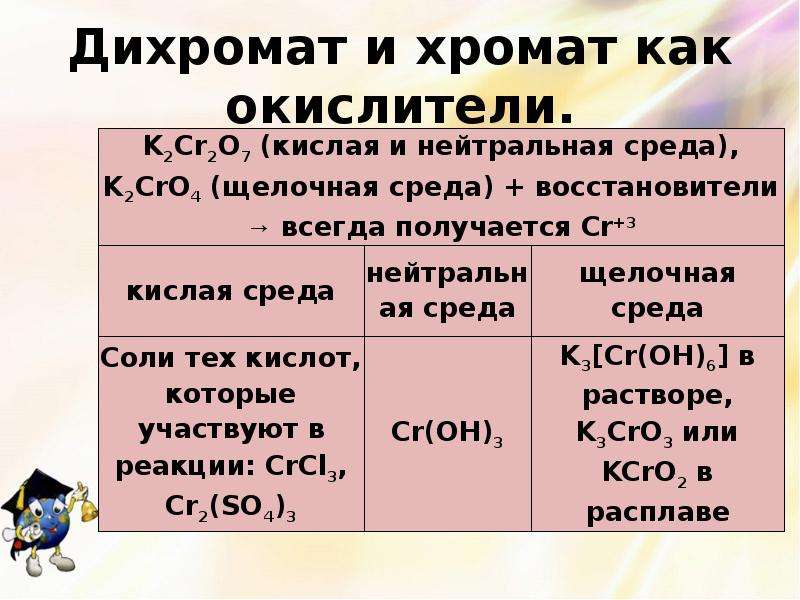
Описание слайда:
Дихромат и хромат как окислители.
Слайд 11
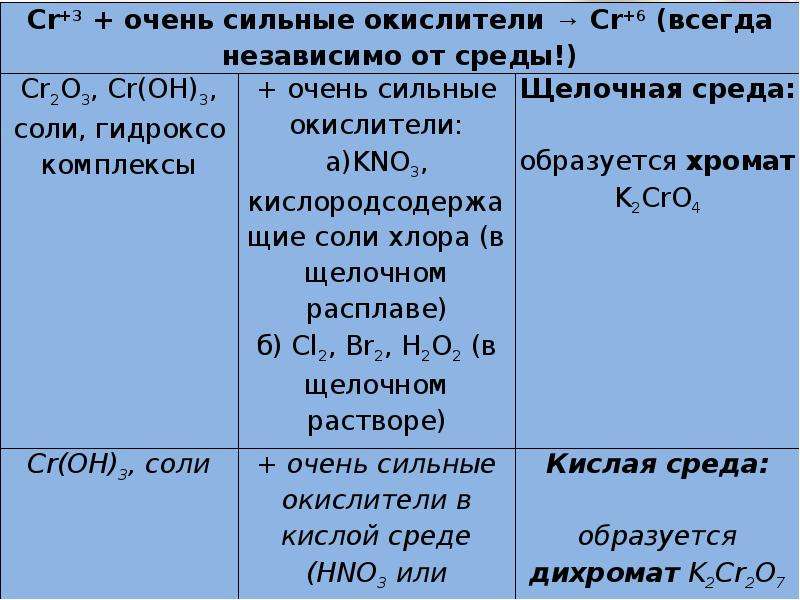
Описание слайда:
Повышение степеней окисления хрома
Слайд 12

Описание слайда:
Азотная кислота с металлами.
— не выделяется водород, образуются продукты восстановления азота
Слайд 13
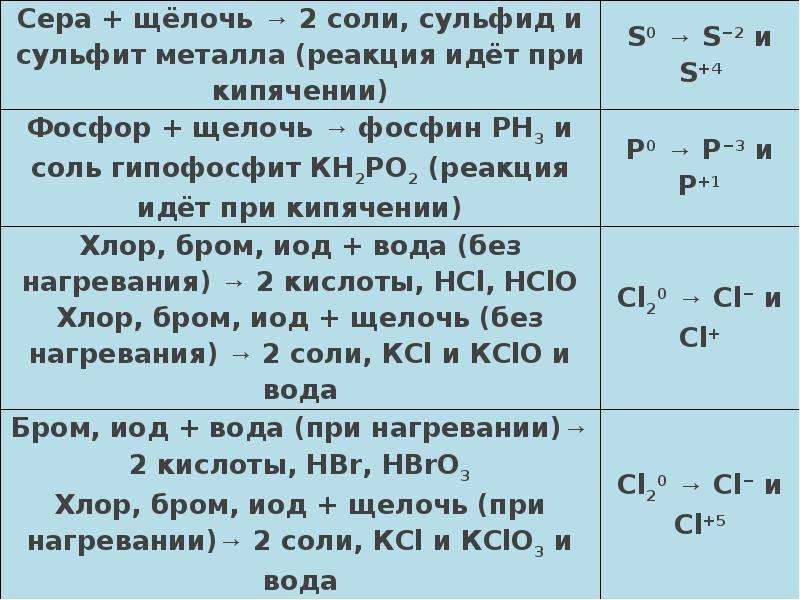
Описание слайда:
Диспропорционирование
Реакции диспропорционирования — это реакции, в которых один и тот же элемент является и окислителем, и восстановителем, одновременно и повышая, и понижая свою степень окисления:
Слайд 14
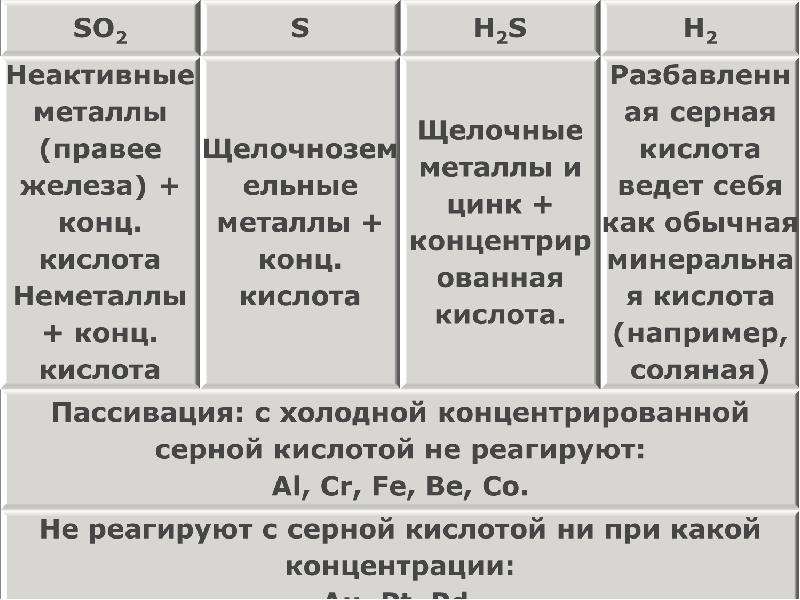
Описание слайда:
Серная кислота с металлами
Слайд 15

Описание слайда:
Диспропорционирование оксида азота (IV) и солей.
Слайд 16

Слайд 17

Описание слайда:
Задание С2 предложено в двух форматах.
Задание С2 предложено в двух форматах.
В одних вариантах КИМ оно будет предложено в прежнем формате
а в других в новом, когда условие задания представляет собой описание конкретного химического эксперимента, ход которого экзаменуемый должен будет отразить посредством уравнений соответствующих реакций.
Слайд 18

Описание слайда:
С2.1. (ПРЕЖНИЙ ФОРМАТ) – 4 БАЛЛА.
ДАНЫ ВЕЩЕСТВА: ОКСИД АЗОТА (IV), МЕДЬ, РАСТВОР ГИДРОКСИДА КАЛИЯ И КОНЦЕНТРИРОВАННАЯ СЕРНАЯ КИСЛОТА. НАПИШИТЕ УРАВНЕНИЯ ЧЕТЫРЕХ ВОЗМОЖНЫХ РЕАКЦИЙ МЕЖДУ ВСЕМИ ПРЕДЛОЖЕННЫМИ ВЕЩЕСТВАМИ, НЕ ПОВТОРЯЯ ПАРЫ РЕАГЕНТОВ.
С2.2.(В НОВОМ ФОРМАТЕ) – 4 БАЛЛА. СОЛЬ, ПОЛУЧЕННУЮ ПРИ РАСТВОРЕНИИ ЖЕЛЕЗА В ГОРЯЧЕЙ КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЕ, ОБРАБОТАЛИ ИЗБЫТКОМ РАСТВОРА ГИДРОКСИДА НАТРИЯ. ВЫПАВШИЙ БУРЫЙ ОСАДОК ОТФИЛЬТРОВАЛИ И ПРОКАЛИЛИ. ПОЛУЧЕННОЕ ВЕЩЕСТВО СПЛАВИЛИ С ЖЕЛЕЗОМ. НАПИШИТЕ УРАВНЕНИЯ ОПИСАННЫХ РЕАКЦИЙ.
Слайд 19

Описание слайда:
1 или 2 реакции обычно «лежат на поверхности», демонстрируя либо кислотные, либо основные свойства вещества
1 или 2 реакции обычно «лежат на поверхности», демонстрируя либо кислотные, либо основные свойства вещества
В наборе из четырех веществ, как правило, встречаются типичные окислители и восстановители. В этом случае как минимум одна представляют собой ОВР
Для написания реакций между окислителем и восстановителем необходимо:
1. предположить, до какого возможного значения повысится степень окисления атома-восстановителя и в каком продукте реакции он будет ее проявлять;
2. предположить, до какого возможного значения понизится степень окисления атома-окислителя и в каком продукте реакции он будет ее проявлять.
Слайд 20
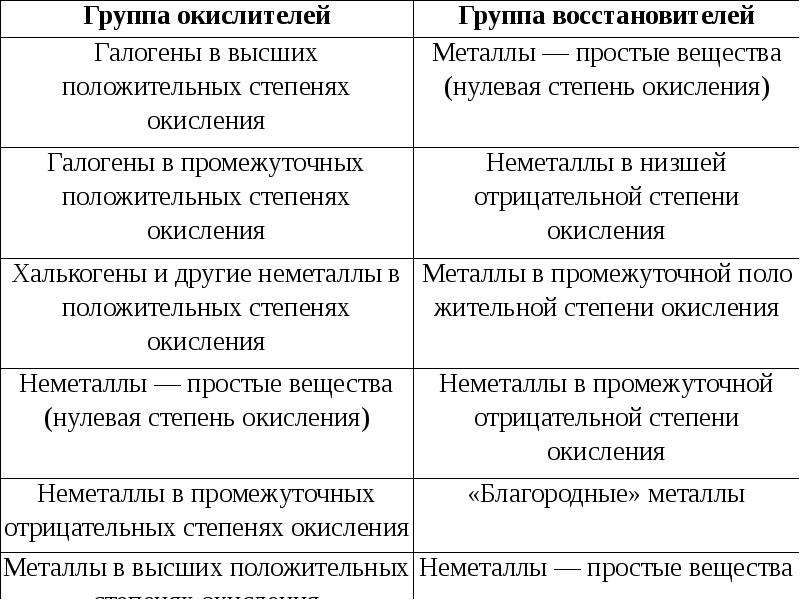
Описание слайда:
Типичные окислители и восстановители в порядке ослабления окислительных и восстановительных свойств
Слайд 21

Описание слайда:
Даны четыре вещества: оксид азота (IV), иодоводород, раствор гидроксида калия, кислород.
Даны четыре вещества: оксид азота (IV), иодоводород, раствор гидроксида калия, кислород.
Слайд 22

Слайд 23

Описание слайда:
Общие свойства классов органических веществ
Общие свойства классов органических веществ
Общие способы получения органических веществ
Специфические свойства некоторых конкретных веществ
Слайд 24
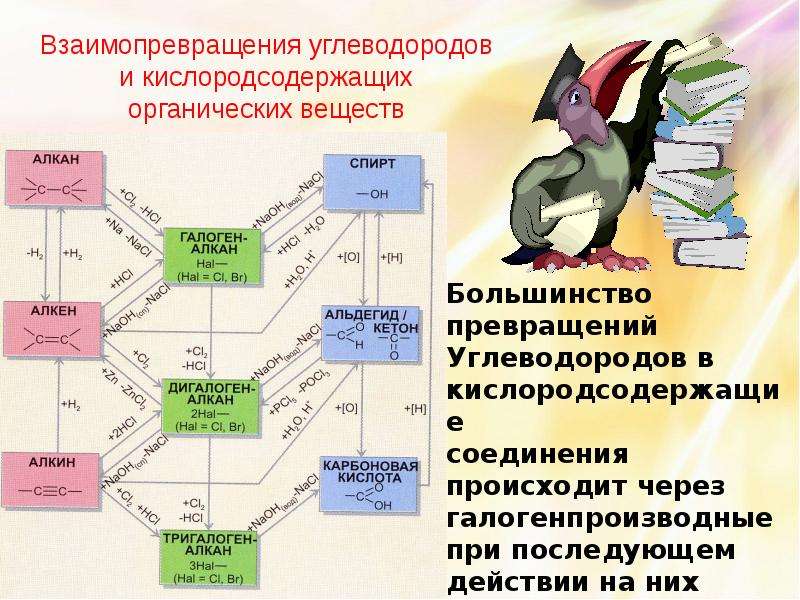
Слайд 25
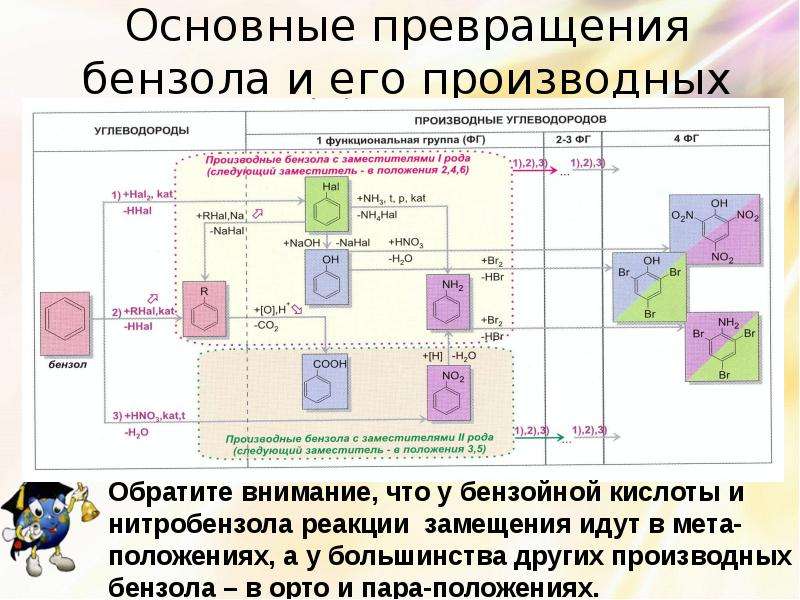
Описание слайда:
Основные превращения бензола и его производных
Слайд 26
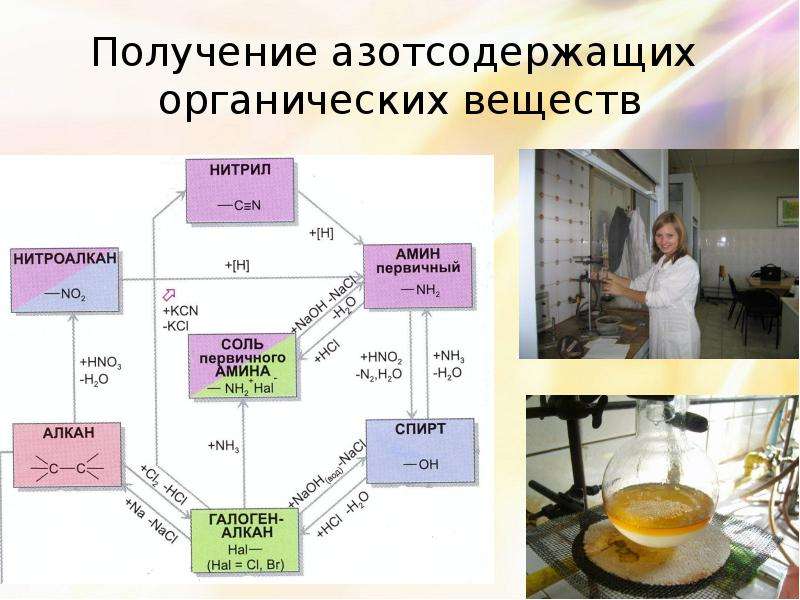
Описание слайда:
Получение азотсодержащих
органических веществ
Слайд 27
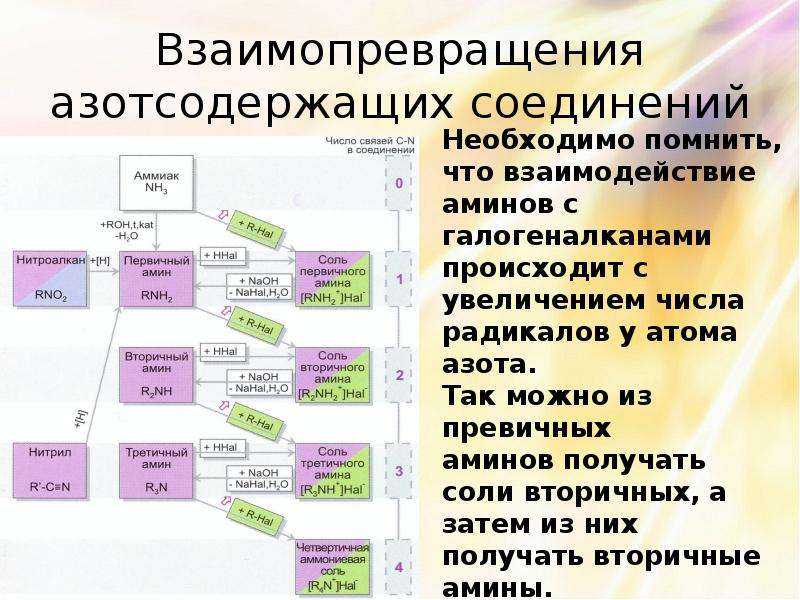
Описание слайда:
Взаимопревращения азотсодержащих соединений
Слайд 28

Описание слайда:
Окислительно-восстановительные свойства кислородсодержащих соединений
Слайд 29
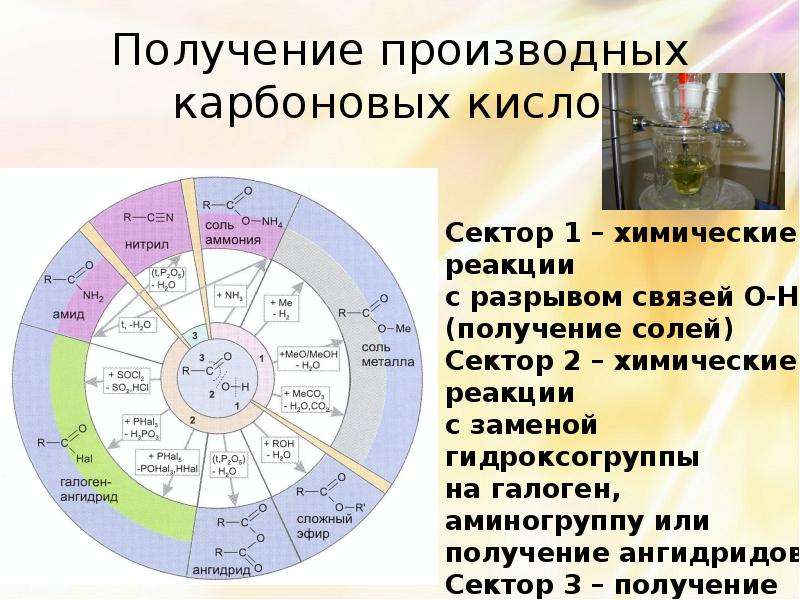
Описание слайда:
Получение производных карбоновых кислот
Слайд 30
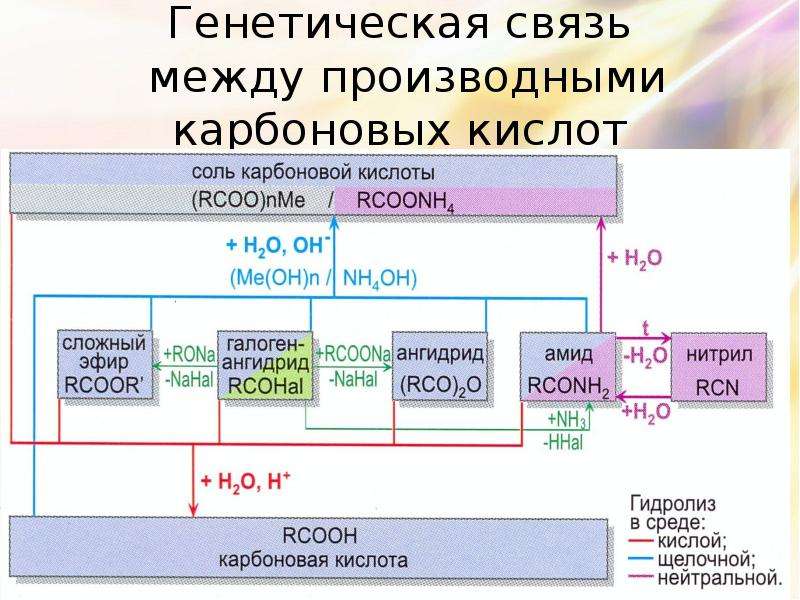
Описание слайда:
Генетическая связь
между производными карбоновых кислот
Слайд 31

Слайд 32

Слайд 33

Описание слайда:
Классификация задач
Слайд 34

Слайд 35

Слайд 36

Слайд 37

Слайд 38

Слайд 39

Слайд 40

Слайд 41

Описание слайда:
Вывод формул
Слайд 42

Слайд 43

Слайд 44

Слайд 45

Слайд 46

Слайд 47

Слайд 48

Слайд 49

Описание слайда:
Список использованной литературы и интернет – ресурсов.
Презентацию на
тему Сложные вопросы ЕГЭ по химии можно скачать бесплатно ниже: