Слайды и текст этой презентации
Слайд 1

Слайд 2

Слайд 3

Слайд 4

Описание слайда:
О каком веществе идёт речь?
У травоядных животных потребность в этом веществе велика. В тех странах, где этого вещества мало, люди прибегали к различным способам чтобы ... Меланезийцы каждое утро пили морскую воду, в Новой Зеландии пищу запивали морской водой, в Северной Америке индейские племена высушивали морскую капусту и добавляли её в пищу.
Слайд 5

Описание слайда:
• научить составлять формулы солей и давать им названия;
• узнать классификацию, свойства солей, способы получения и применение солей.
Слайд 6

Описание слайда:
Задачи:
Научить
находить среди неорганических веществ формулы солей;
составлять формулы солей;
называть соли.
Слайд 7

Описание слайда:
План урока:
6. Химические свойства.
Слайд 8
Слайд 9

Описание слайда:
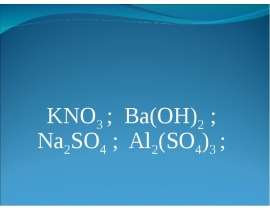
Найдите среди формул веществ-
формулы солей
CO2 H2 SO4 CaO
BaSO4 K2SO4 Fe(OH)3
HCl MgCO3 H2O
Слайд 10
Описание слайда:
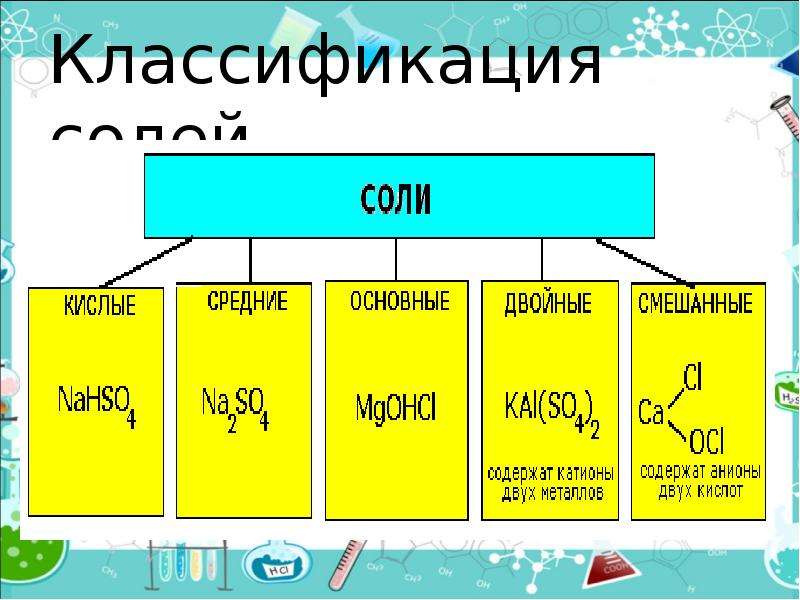
Классификация солей
Слайд 11

Описание слайда:
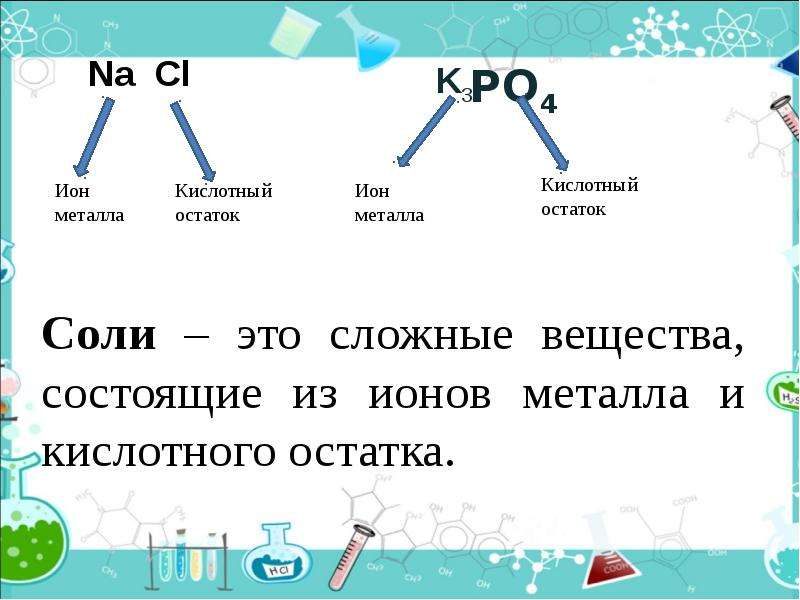
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла (KCl)
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла (KCl)
Кислые соли — атомы водорода в кислоте замещены атомами металла частично (NaHCO3)
Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. ( ( CuOH)2CO3)
Слайд 12

Описание слайда:
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами (KAl(SO4)2х12H2O)
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами (KAl(SO4)2х12H2O)
Смешанные соли — в их составе присутствует два различных аниона (Ca(OCl)Cl)
Слайд 13

Описание слайда:
Номенклатура средних солей
Слайд 14

Описание слайда:
Номенклатура кислых солей
Слайд 15

Описание слайда:
Номенклатура основных солей
Слайд 16

Описание слайда:
Номенклатура двойных солей
Слайд 17

Описание слайда:
Номенклатура смешанных солей
Слайд 18

Описание слайда:
Составить формулы солей:
нитрита магния,
силиката натрия,
фосфата кальция.
Слайд 19
Описание слайда:
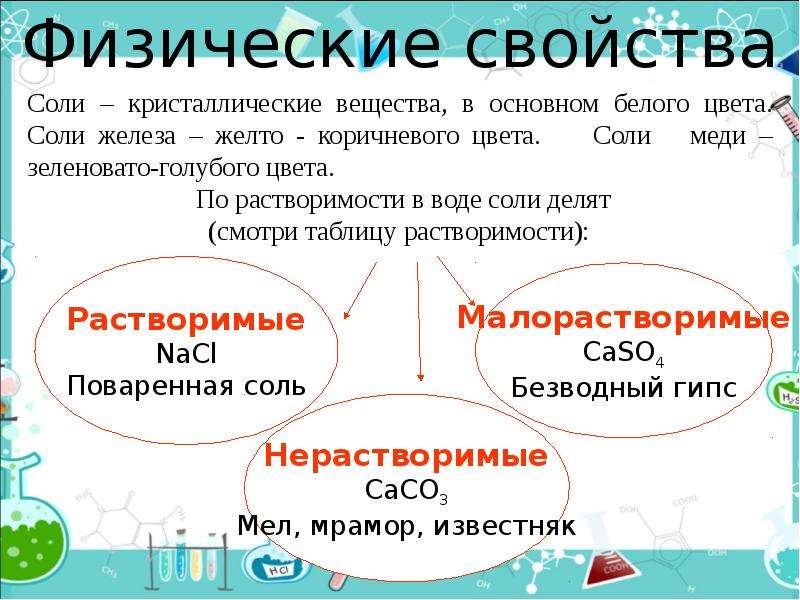
Физические свойства
Слайд 20

Описание слайда:
Химические свойства
1. Взаимодействие с металлами. Каждый левее стоящий металл в ряду напряжений вытесняет последующий из раствора его соли.
Fe + CuCI2=Cu + FeCI2
Fe° + Cu²+ + 2CI = Cu° + Fe²+ +2CI-
Fe° + Cu²+ = Cu° + Fe²+
или Fe° – 2e → Fe²+ │ процесс окисления (восстановитель)
Cu²+ + 2e → Cu° │ процесс восстановления (окислитель)
Слайд 21

Описание слайда:
Химические свойства
2. Взаимодействие со щелочами:
В результате обязательно должно образоваться нерастворимое основание.
3. Взаимодействие солей между собой:
Слайд 22
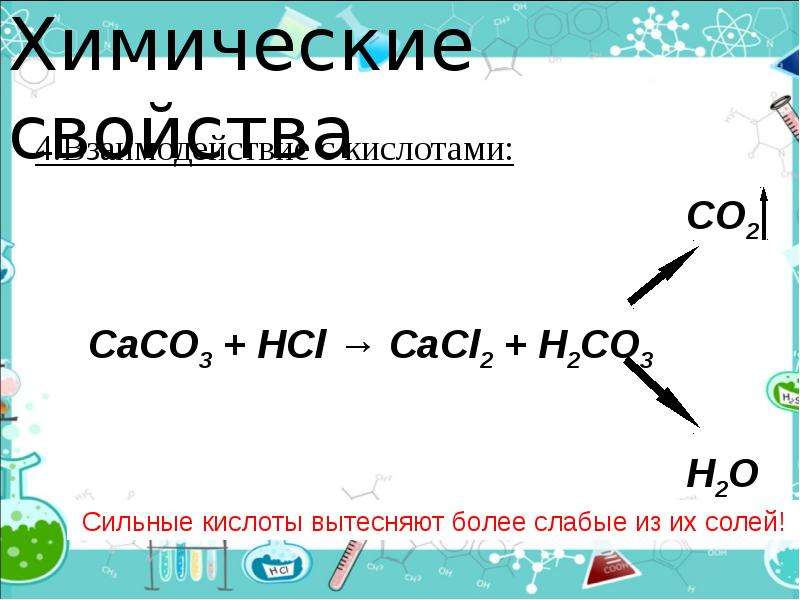
Описание слайда:
Химические свойства
4.Взаимодействие с кислотами:
Слайд 23
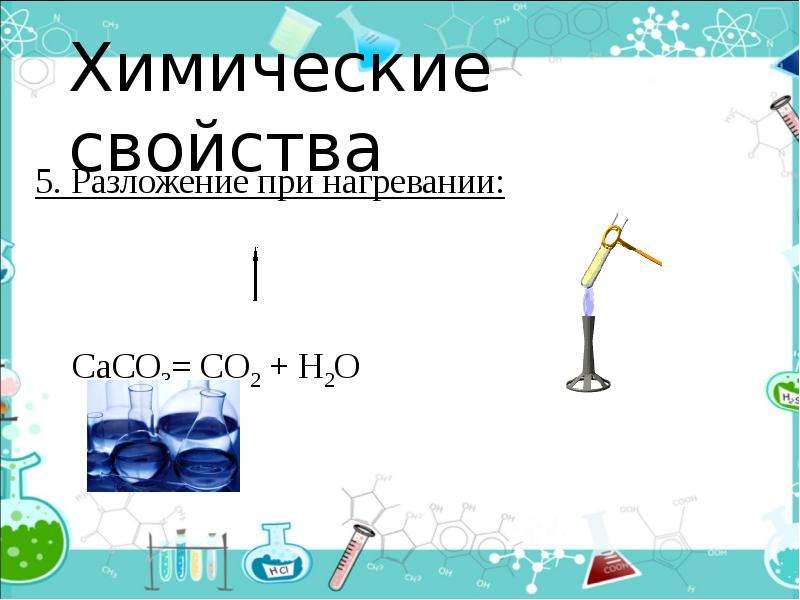
Описание слайда:
Химические свойства
5. Разложение при нагревании:
СаСО3= СО2 + Н2О
Слайд 24

Описание слайда:
Способы получения
1. Кислота + основание = соль + вода
H2SO4 +2NaOH = Na2SO4 + 2H2O
2. Кислота + металл = соль + водород
2HCL +Zn = ZnCL2 + H2
3. Кислота + основный оксид = соль + вода
2HCL + CuO = CuCL2 + H2O
4. Кислота + соль = новая кислота + новая соль
H2SO4 + BaCL2 = 2HCL + BaSO4
Условия: в результате реакции должны получиться газ, осадок или вода.
Слайд 25

Описание слайда:
Способы получения
5. Основание + соль = новое основание + новая соль
2КОН + СаSO4 = Са(ОН) 2 + К2SO4
6. Основание + кислотный оксид + = соль + вода
2NaOH + SO3 = Na2SO4 + H2O
7. Кислотный оксид + основный оксид = соль
СО2+ СаО = СаСО3
8. Соль + соль = новая соль + новая соль
КСl + AgNO3 → AgCl + KNO3
9. Соль + металл = новая соль + металл
CuSO4 + Fe = FeSO4 + Cu
10. Металл + неметалл = соль
Fe +S = FeS
Слайд 26

Описание слайда:
Применение солей
Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия.
Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды.
Хлорид калия используют в сельском хозяйстве как калийное удобрение.
Слайд 27

Описание слайда:
Применение солей
Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс.
Декагидрат сульфата натрия используют в качестве сырья для получения соды.
Слайд 28

Описание слайда:
Применение солей
Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.
Слайд 29

Описание слайда:
Применение солей
Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести.
Карбонат натрия (соду) применяют в производстве стекла и при варке мыла.
Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
Слайд 30

Описание слайда:
О соли
Мёртвое море
Слайд 31

Описание слайда:
Розовое озеро в Сенегале
Это озеро имеет такой цвет из-за большого количества микроорганизмов и полезных ископаемых. Местные женщины проводят до 14 часов в день собирая там соль.
Слайд 32

Описание слайда:
Самое большое солевое озеро в мире расположено на юге пустынной равнины Альтиплано, в Боливии, на высоте около 3700 м. Его площадь составляет 10,5 квадратных километров. В центре толщина соли достигает 10 метров. Это озеро содержит более 10 миллиардов тонн соли. Когда Salar de Uyuni покрывается водой, в нем отражается каждое облако.
Слайд 33

Описание слайда:
Химический диктант
Слайд 34

Слайд 35

Слайд 36

Описание слайда:
Домашнее задание
§33, Упр.2, 3, 6 (письменно)
Слайд 37

Описание слайда:
СПАСИБО
ЗА УРОК!
Слайд 38

Описание слайда:
Список используемых источников
Презентацию на
тему Соли: свойства, получение, применение (8 класс) можно скачать бесплатно ниже: