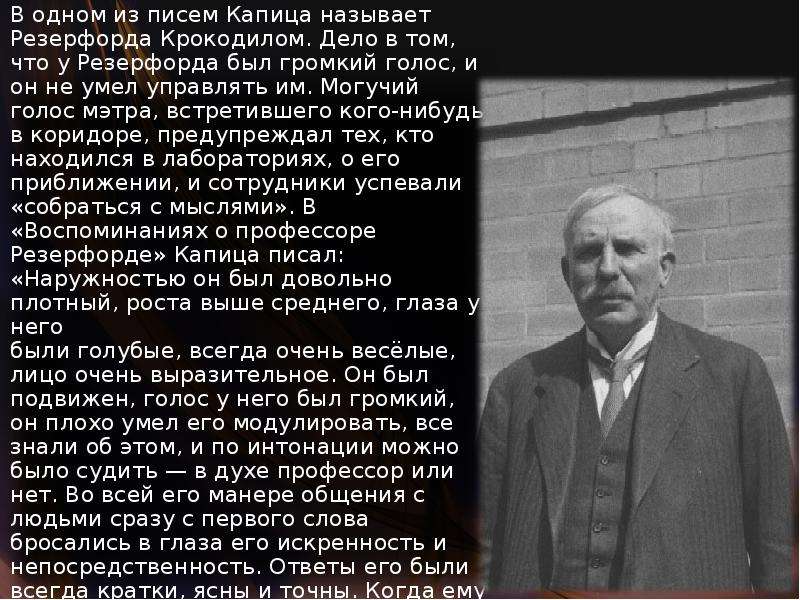
Описание слайда:
После получения Нобелевской премии Резерфорд занялся изучением явления, которое наблюдалось при бомбардировке пластинки тонкой золотой фольги альфа-частицами, излучаемыми таким радиоактивным элементом, как уран. Оказалось, что с помощью угла отражения альфа-частиц можно изучать структуру устойчивых элементов, из которых состоит пластинка. Согласно принятым тогда представлениям, модель атома была подобна пудингу с изюмом: положительные и отрицательные заряды были равномерно распределены внутри атома и, следовательно, не могли в значительной мере изменять направление движения альфа-частиц. Резерфорд, однако, заметил, что определённые альфа-частицы отклонялись от ожидаемого направления в значительно большей степени, чем это допускалось теорией. Работая с Эрнестом Марсденом, студентом Манчестерского университета, учёный подтвердил, что довольно большое число альфа-частиц отклоняется дальше, чем ожидалось, причём некоторые под углом более чем 90 градусов.
Размышляя над этим явлением. Резерфорд в 1911 году предложил новую модель атома. Согласно его теории, которая сегодня стала общепринятой, положительно заряженные частицы сосредоточены в тяжёлом центре атома, а отрицательно заряженные (электроны) находятся на орбите ядра, на довольно большом расстоянии от него. Эта модель, подобна крошечной модели Солнечной системы, подразумевает, что атомы состоят главным образом из пустого пространства.
Широкое признание теории Резерфорда началось, когда к работе учёного в Манчестерском университете подключился датский физик Нильс Бор. Бор показал, что в терминах предлагаемой Резерфордом структуры могут быть объяснены общеизвестные физические свойства атома водорода, а также атомов нескольких более тяжёлых элементов.
Но, к несчастью, плодотворная работа резерфордовской группы в Манчестере была прервана Первой мировой войной.