Слайды и текст этой презентации
Слайд 1

Описание слайда:
Атомная физика
11 класс
Слайд 2

Описание слайда:
План урока
1. Из истории физики
2. Модель Томсона
3. Опыт Резерфорда
4. Противоречия
5.Постулаты Бора
6.Энергетическая диаграмма атома водорода
7. Сообщения о Э.Резерфорде и Н. Боре
Слайд 3

Описание слайда:
Конец XIX века.
Из истории физики…
1869г. Д.Менделеев открыл
периодический закон
1896 г. А.Беккерель открыл явление
радиоактивности
1897 г. Томсон открыл электрон
1903 г. Томсон предложил модель атома
Слайд 4

Описание слайда:
Модель атома Томсона
Слайд 5

Описание слайда:
Эрнест Резерфорд (1871-1937) – великий английский физик
Эрнест Резерфорд (1871-1937) – великий английский физик
Слайд 6

Описание слайда:
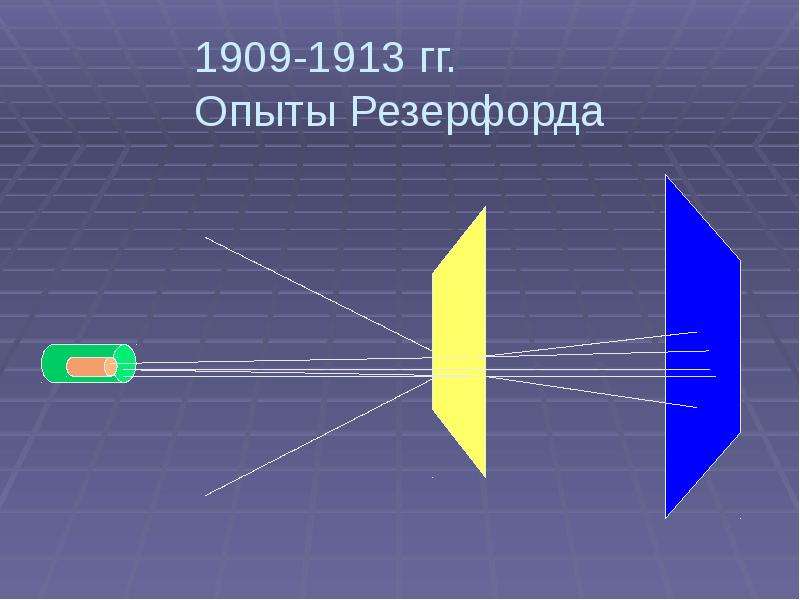
1909-1913 гг.
Опыты Резерфорда
Цель:
1. Исследование распределения
положительного заряда
2. Исследование распределения
массы внутри атома
Слайд 7
Описание слайда:
1909-1913 гг.
Опыты Резерфорда
Слайд 8

Описание слайда:
1909-1913 гг.
Опыты Резерфорда
Результаты:
1. Большинство частиц проходит
через фольгу не отклоняясь
Слайд 9

Описание слайда:
1909-1913 гг.
Опыты Резерфорда.
Выводы:
1. Положительный заряд атома и его масса сконцентрированы в очень малой области пространства – ядро
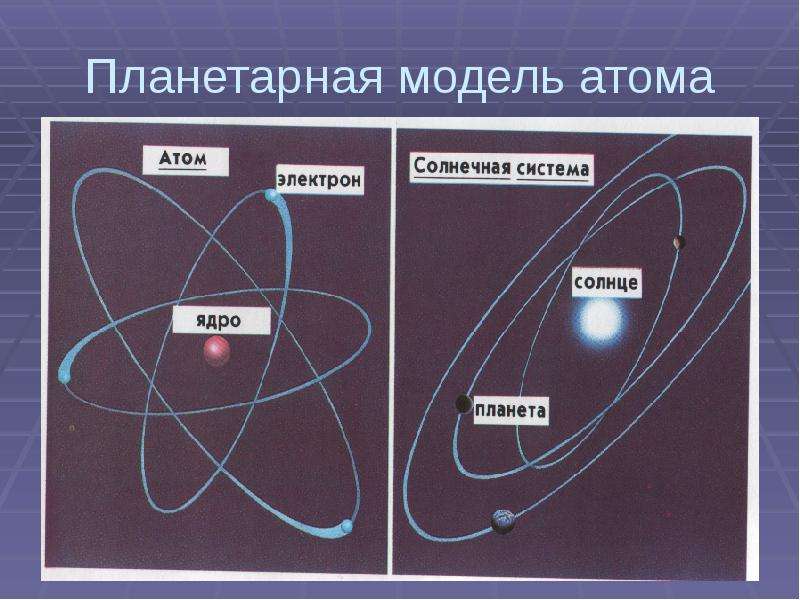
2. Предложена новая модель атома – планетарная
3. Ядро имеет диаметр 10 -12 -10 -13 см
4. Размер атома 10 -8 см
5. Заряд ядра равен номеру химического элемента по таблице Д.И.Менделеева
Слайд 10
Описание слайда:
Планетарная модель атома
Слайд 11

Описание слайда:
Противоречие
между экспериментальными данными и теорией
Ускоренное движение электрона по орбите должно сопровождаться постоянным излучением
Излучение сопровождается излучением энергии и электрон должен двигаться по спирали в итоге должен упасть на ядро
Слайд 12

Описание слайда:
Нильс Бор (1885-1962)
великий датский физик
Слайд 13

Описание слайда:
1913 г. Нильс Бор
Разрешая противоречия, учёл:
1. Линейчатый спектр атомов
2. Модель атома Резерфорда
3. Квантовый характер испускания и поглощения энергии
Слайд 14

Описание слайда:
Постулаты Бора
1. Атомная система может находиться только в особых стационарных, или квантовых состояниях, каждому из которых соответствует определенная энергия Е n ; в стационарном состоянии атом не излучает
Слайд 15
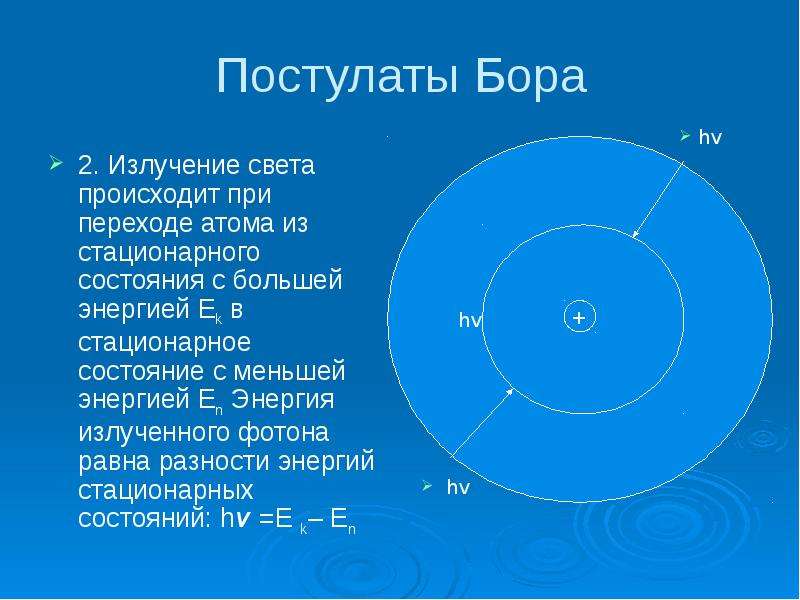
Описание слайда:
Постулаты Бора
2. Излучение света происходит при переходе атома из стационарного состояния с большей энергией Еk в стационарное состояние с меньшей энергией Еn Энергия излученного фотона равна разности энергий стационарных состояний: hv =E k– En
Слайд 16

Описание слайда:
Постулаты Бора
3. Возможен дискретный ряд орбит по которым электрон может двигаться в стационарном состоянии:
m v r = n h,
m-масса электрона,
v -скорость электрона,
r-радиус данной орбиты,
n-номер орбиты,
h-постоянная (1,05•10-34 Дж•с)
Слайд 17

Описание слайда:
Энергетические уровни атома водорода
Слайд 18

Описание слайда:
Благодарю за внимание и работу на уроке
Презентацию на
тему Атомная физика (11 класс) можно скачать бесплатно ниже: