Описание слайда:
9. Красители (бриллиантовый зелёный, метиленовый синий, риванол, основной фуксин). Взаимодействуют с нуклеиновыми кислотами, нарушая их функции.
9. Красители (бриллиантовый зелёный, метиленовый синий, риванол, основной фуксин). Взаимодействуют с нуклеиновыми кислотами, нарушая их функции.
10. Окислители (наиболее распространённые - перекись водорода, перманганат калия), окисляют метаболиты и ферменты микроорганизмов, либо денатурируют микробные белки.
11. Гуанидины (полиалкиленгуанидины) связываются с белками ЦПМ, что приводит к ее разрыву, блокируют гликолитические ферменты дыхательной системы микробной клетки.
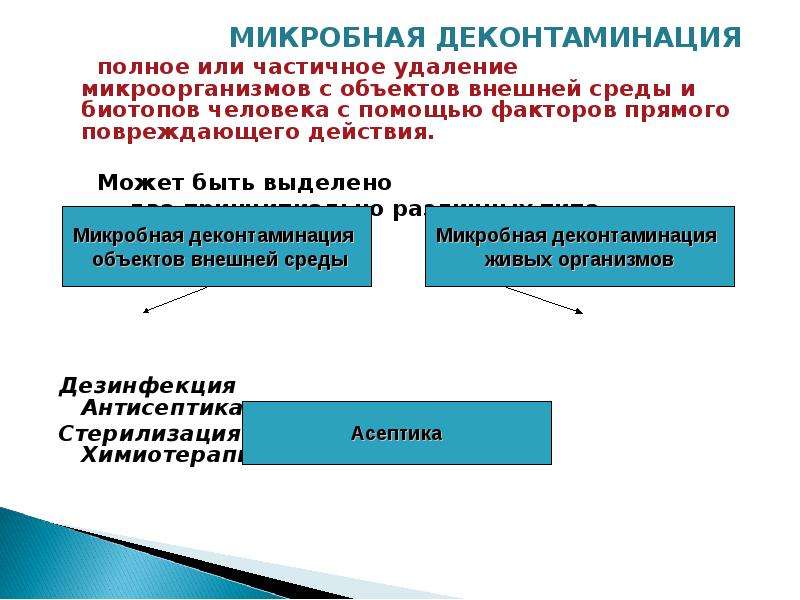
12. Металлы. Серебро.
Механизм действия серебра на микроорганизмы хотя и изучается, но пока до конца не раскрыт.
Чистое серебро инертно и не реагирует на ткани человека или микроорганизмы до ионизации. Биоактивен именно его ион, легко связывающийся с отрицательно заряженными белками, РНК, ДНК, ионами хлора и т. д. Чувствительные к серебру бактерии имеют способность поглощать и концентрировать в себе его ионы. Антимикробное действие практически мгновенно, как только серебро достигает микроорганизма. Принято считать, что концентрация 105–107 ионов серебра на бактериальную клетку летальна.
В 1968 г. Чарльз Фокс представил сульфадиазин серебра, и он оказался наиболее успешным антимикробным препаратом с широким спектром активности: для гибели бактерий и грибов на коже достаточно 1% мази. Мазь сульфадиазина серебра стала стандартом антибактериального лечения обширных ожогов, широко применяют ее и сегодня.
В последние годы предложены различные серебросодержащие повязки для лечения ран (silverlon, silvasorb, contreet-H, arglaеs, aquacel-Ag и другие). Они более практичны, чем серебро в растворе, соли, цельном веществе. «Основой» для таких перевязочных материалов служат полимерная ткань, гидроколлоидные, угольные повязки, пленки, гидроволокна и др.