Слайды и текст этой презентации
Слайд 1

Описание слайда:
УРОК ФИЗИКИ В 10 КЛАССЕ
Основные положения МКТ
Учитель Кононов Геннадий Григорьевич
СОШ № 29 Славянский район
Краснодарского края
Слайд 2

Слайд 3

Описание слайда:
СОЗДАТЕЛИ АТОМНОЙ ТЕОРИИ
Джон Дмитрий
Дальтон Менделеев
Амедео Эрнест
Авогадро Резерфорд
Слайд 4

Слайд 5

Описание слайда:
Основные положения МКТ
• Все тела состоят из малых частиц, между которыми есть промежутки.
• Частицы тел постоянно и беспорядочно движутся.
• Частицы тел взаимодействуют друг с другом: притягиваются и отталкиваются.
Слайд 6

Описание слайда:
ПЕРВОЕ ПОЛОЖЕНИЕ
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, атомов, ионов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Слайд 7

Описание слайда:
ВТОРОЕ ПОЛОЖЕНИЕ
Траектория одной частицы
Движение Движение
молекул молекул
газа твердых тел
Слайд 8
Описание слайда:
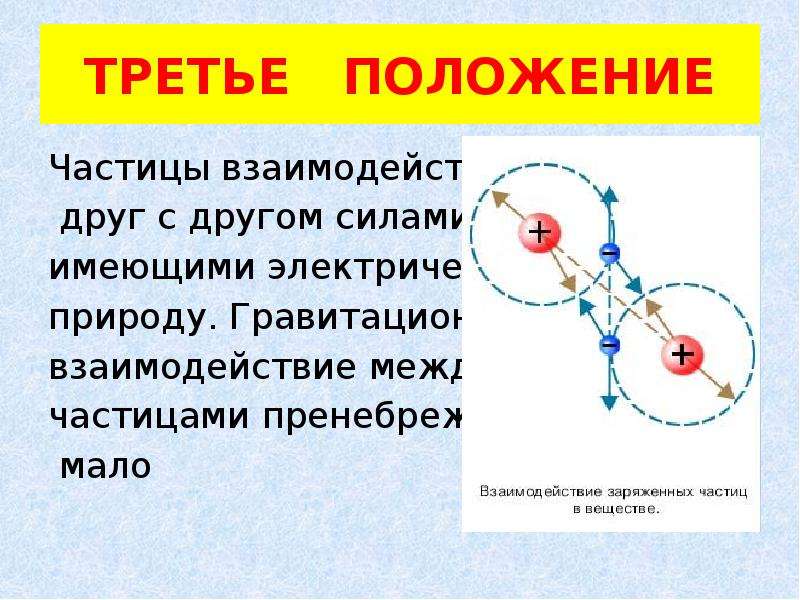
ТРЕТЬЕ ПОЛОЖЕНИЕ
Частицы взаимодействуют
друг с другом силами,
имеющими электрическую
природу. Гравитационное
взаимодействие между
частицами пренебрежимо
мало
Слайд 9

Описание слайда:
ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
I положение
1. Дробление вещества
2. Испарение жидкостей
3. Расширение тел при нагревании
Слайд 10

Описание слайда:
ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
II положение
1. Диффузия – перемешивание молекул
разных веществ
2.Броуновское движение – движение взвешенных в жидкости частиц
Слайд 11

Описание слайда:
ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
III положение
Силы упругости
Прилипание свинцовых цилиндров
Смачивание
Поверхностное натяжение
Слайд 12

Описание слайда:
ОЦЕНКА РАЗМЕРОВ МОЛЕКУЛ
Слайд 13
Слайд 14

Описание слайда:
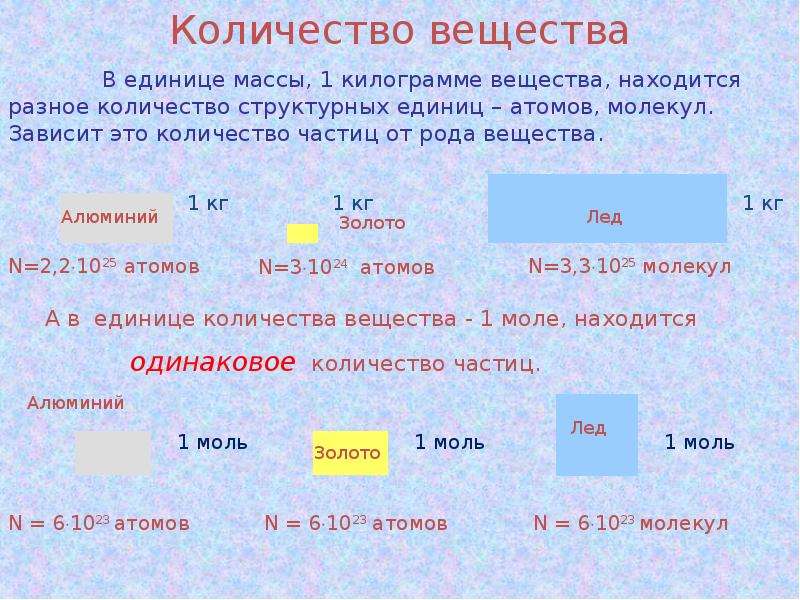
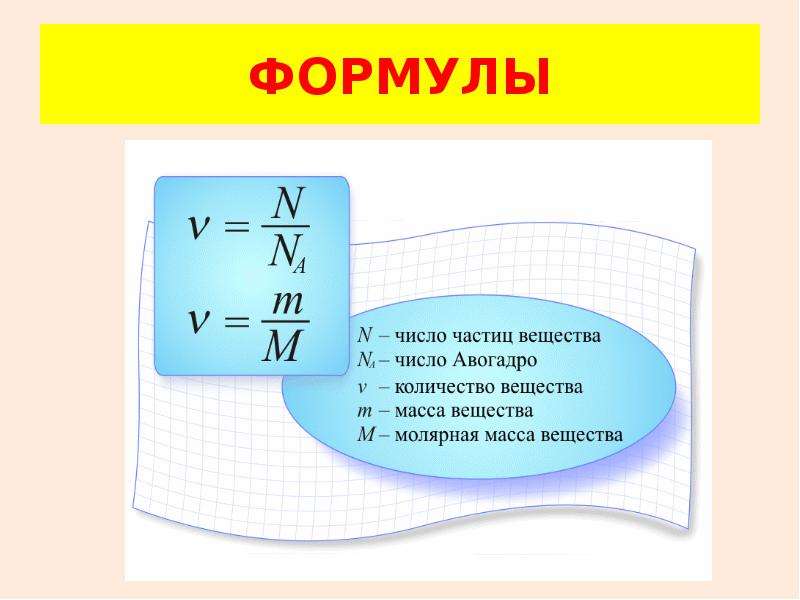
КОЛИЧЕСТВО ВЕЩЕСТВА
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C.
Слайд 15
Слайд 16

Описание слайда:
МОЛЯРНАЯ МАССА
В одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NA:
NA = 6·1023 моль–1
Все газы двухатомны, кроме инертных
М(Н2) = 2г/моль М(О2) = 32г/моль
М(N2) = 28г/моль М(Не) = 4г/моль
Слайд 17
Описание слайда:
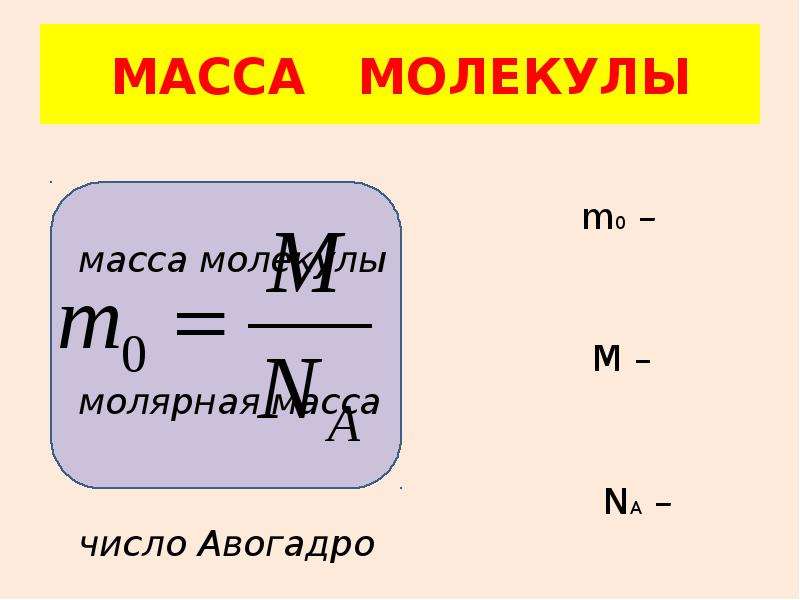
МАССА МОЛЕКУЛЫ
m0 – масса молекулы
М – молярная масса
NА – число Авогадро
Слайд 18

Описание слайда:
ЗАДАЧИ
1. Рассчитать массу молекулы Н2SО4.
М(Н2SО4) = 2·1 + 32 + 16·4 = 98 г/моль
Слайд 19

Описание слайда:
ЗАДАЧИ
2. Сколько молекул содержится в 50г Аℓ?
М(Аℓ) = 27г/моль
N = νNA ν = m/M
ν = 50г:27г/моль = 1,85моль
N = 1,85·6·10²³ = 11·10²³
Слайд 20

Описание слайда:
ДОМАШНЕЕ ЗАДАНИЕ
§ 58, 59 Упр.11 (1,4)
Выучить основные положения МКТ
Знать обозначения величин
Уметь описать опыт по определению размеров частиц
Презентацию на
тему Основные положения молекулярно-кинетической теории можно скачать бесплатно ниже: