Описание слайда:
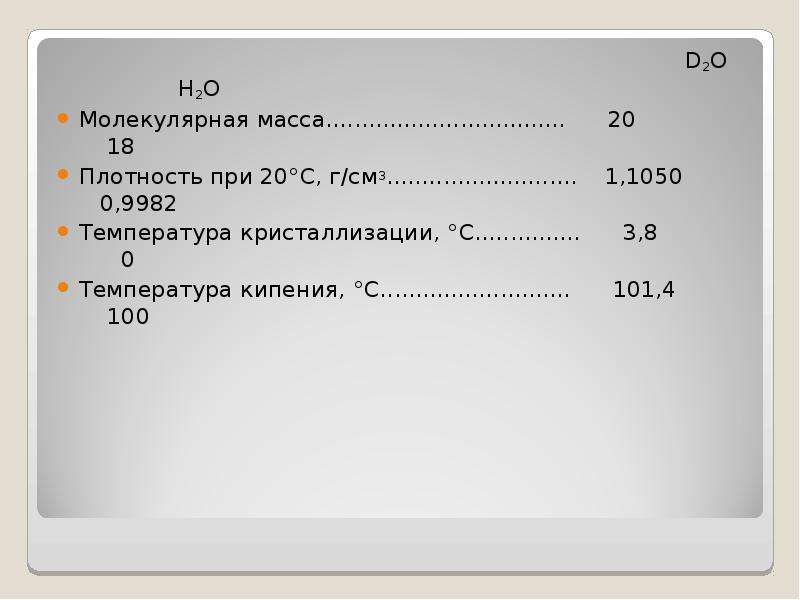
Молекула воды имеет угловую форму: атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды – диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, - отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы. В жидкой воде наряду с обычными молекулами Н2О содержатся ассоцированные молекулы, т.е. соединённые в более сложные агрегаты (Н2О)х, благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии её физических свойств; максимальная плотность при 4°С, высокая температура кипения (в ряду Н2О – Н2S – Н2Se – H2Se – H2Te), аномально высокая теплоёмкость [4,18 кДж/(г·К]. С повышением температуры водородные связи разрываются, и полный разрыв их наступает при переходе воды в пар.
Молекула воды имеет угловую форму: атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды – диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, - отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы. В жидкой воде наряду с обычными молекулами Н2О содержатся ассоцированные молекулы, т.е. соединённые в более сложные агрегаты (Н2О)х, благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии её физических свойств; максимальная плотность при 4°С, высокая температура кипения (в ряду Н2О – Н2S – Н2Se – H2Se – H2Te), аномально высокая теплоёмкость [4,18 кДж/(г·К]. С повышением температуры водородные связи разрываются, и полный разрыв их наступает при переходе воды в пар.