Слайды и текст этой презентации
Слайд 1

Описание слайда:
Тема урока
Железо
Цель урока: Рассмотреть электронное строение атома железа, дать общую характеристику его. Изучить основные физические и химические свойства .Рассмотреть важнейшие соединения железа (ll) и (lll).Ознакомиться с природными соединениями железа и с качественными реакциями на ионы железа (ll) и (lll).
Слайд 2

Описание слайда:
Проверка домашнего задания
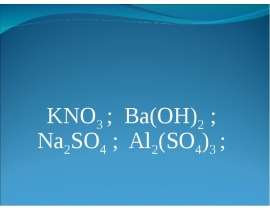
Упражнение №5
Al2 (SO4)3+ KOH(нед) =
Al 2(SO4)3+ KOH(изб.) =
Упражнение №6
Al AlCl3 Al(OH)2 Al2 O3 NaAlO2 Al 2(SO4)3 Al(OH)3 AlCl3 NaAlO2
Слайд 3

Описание слайда:
Ответы
Упражнения №5
1.Al2 (SO4)3 + 6KOH(нед.) = 2AL(OH)3 +3K2SO4
2. Al2 (SO4)3 + 8KOH(изб) = 2KAlO2 + 3K2SO4 +
4H2O
Слайд 4

Описание слайда:
Упражнение №6
2Al +3Cl2 = 2AlCl3
AlCl3 + 3NaOH =Al(OH)3 + 3NaCl
2Al(OH)3 = Al2O3 + 3H2O
Al2O3 +2NaOH =2NaAlO2 + H2O
2NaAlO2 + 4H2SO4(изб.) = Na2SO4 + Al2 (SO4 )3 +4H2O
Al2 (SO4 ) + 6NaOH = 2Al (OH)3 + 3Na2 SO4
Al(OH)3 +3HCl =AlCl3 + 3H2O
AlCl3 + 4NaOH(избыт.)= NaAlO2 + 3NaCl + 2H2O
Слайд 5

Описание слайда:
Изучение нового материала
Характеристика по плану:
1.Положение железа в ПСХЭ (период, ряд, группа, подгруппа, порядковый номер)
2.Атомное строение(число электронов, протонов , нейтронов, относительная атомная масса)
3.Электронные слои, распределение электронов по слоям, электронная конфигурация.
Слайд 6

Описание слайда:
Характеристика элемента
4-период, 4ряд, 8-группа, побочная подгруппа, порядковый номер 26
26 электронов, 26 протонов, относительная атомная масса 56, 30 нейтронов.
4 электронных слоя, 2)8)14)2), электронная конфигурация 1s22s2p63s2p6d64s2
Степень окисления 0,+2, +3 ,+4 и иногда + 6; является восстановителем
Слайд 7

Описание слайда:
Физические свойства железа
Серебристо-серый, мягкий металл, обладает хорошей пластичностью, ковкостью и способностью к намагничиванию.
Плотность 7,864г/см3, температура плавления 1539 * С
Слайд 8
Описание слайда:
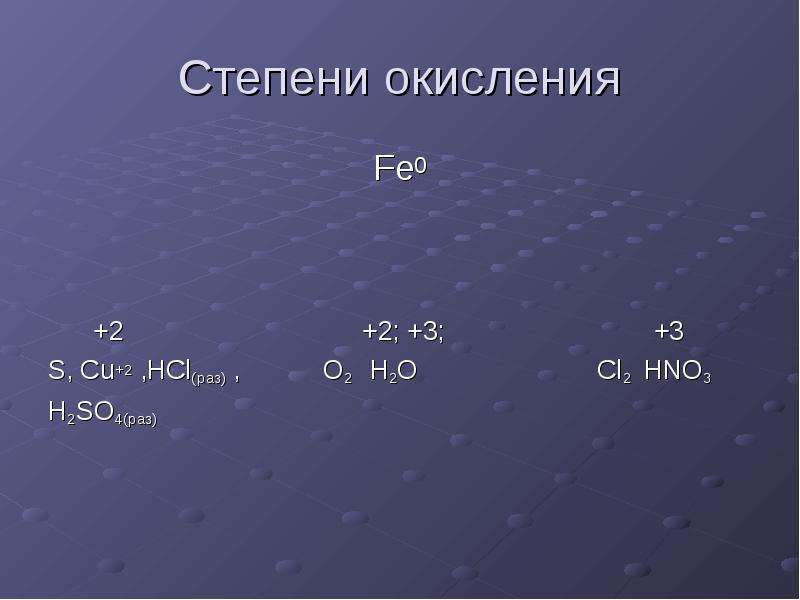
Степени окисления
Fe0
+2 +2; +3; +3
S, Cu+2 ,HCl(раз) , O2 H2O Cl2 HNO3
H2SO4(раз)
Слайд 9

Описание слайда:
Химические свойства
При нагревании
2Fe + 3Cl2 =2FeCl3
3Fe +2O2= Fe3O4 (FeO Fe2O3)
Fe +S =FeS
При очень высокой температуре
4Fe + 3C =Fe4C3
4Fe + 3Si =Fe4Si3
3Fe + 2P = Fe3P2
Слайд 10

Описание слайда:
Химические свойства
Fe + CuSO4 = Cu + FeSO4
Fe + 2HClр = FeCl2 + H2
Fe + H2SO4 p= FeSO4 + H2
Fe + H2SO4(k) =/=
Fe + HNO3 (к)=/=
Слайд 11

Описание слайда:
При нагревании
2Fe + 6H2SO4(k)=Fe2(SO4)3 + 3SO2+6H2O
Fe+ 6HNO3(k)= Fe(NO3)3+ 3NO2+ 3H2O
Слайд 12

Описание слайда:
Химические свойства
Fe0 + HNO3 (p) = Fe +2(NO3 )2 + N20 + H2 O
Fe0 + HNO3(р) = Fe+3 (NO3)3 + N+2 O + H20
Fe0 + HNO3(р) = Fe+2(NO3)2 + N-3 H4 N+5 O3+ H2O
Слайд 13

Описание слайда:
Уравнивание реакций
5Fe0 + 12 HN+5 O3 (p) = 5Fe +3(NO3 )2 + N20 +6 H2 O
вос-ль окис-ль
Fe0 - 2e = Fe+2 10 1
2N+5 + 10e = N20 2 5
Fe0 +4 HN+5 O3 = Fe+3 (NO3)3 + N+2 O + 2H20
Fe0 - 3e = Fe+3 3 1
N+5 + 3e = N+2 3 1
Fe0 – восстановитель
HNO3 – окислитель
4Fe0 +10 HNO3 =4 Fe+2(NO3)2 + N-3 H4 N+5 O3+ 3H2O
вос-ль окис-ль
Fe0 - 2e = Fe+2 8 4
N+5 + 8e = N-3 2 1
Слайд 14

Описание слайда:
Минералы железо
Fe3O4 магнитный железняк или магнетит
Fe2O3 красный железняк или гематит
2Fe2O3.3H2O бурый железняк или лимонит
FeS2 железный или серный колчедан
FeSO4.7H2O железный купорос
Слайд 15

Описание слайда:
Применение
Магнитный, красный, бурый железняки –для производства черной металлургии (чугуна и стали)
Железный колчедан – для производства серной кислоты
Железный купорос– для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины
Соединение железа издавна применяют для лечения малокровия, при истощении, упадке сил.
Чугун и сталь в технике и в быту.
Хлорид железа(lll)– при очистке воды, в качестве протравы при крашении тканей.
Сульфат железа(lll) при очистке воды, в качестве растворителя в гидрометаллургии .
Слайд 16

Описание слайда:
Источники железа
Шпинат
Салат
Капуста
Черная черешня
Говядина
Телятина
Слайд 17
![Качественная реакция на катионы железа
K3[Fe(CN)6]—красная кровяная соль
K4[Fe(CN)6]– желтая кровяная соль
FeCl2+ K3[Fe(CN)6 = KFe[Fe(CN)6]
турнбуллева синь
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]
берлинская лазурь
KFe+2 [Fe+3 (CN)6] = KFe+3 [Fe+2 (CN)6]
Турнбуллева синь берлинская лазурь](/documents_2/7e214729df72dfdead957e665e099c51/img16.jpg)
Описание слайда:
Качественная реакция на катионы железа
K3[Fe(CN)6]—красная кровяная соль
K4[Fe(CN)6]– желтая кровяная соль
FeCl2+ K3[Fe(CN)6 = KFe[Fe(CN)6]
турнбуллева синь
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]
берлинская лазурь
KFe+2 [Fe+3 (CN)6] = KFe+3 [Fe+2 (CN)6]
Турнбуллева синь берлинская лазурь
Презентацию на
тему Железо можно скачать бесплатно ниже: