Слайды и текст этой презентации
Слайд 1

Описание слайда:
Количество вещества. Молярная масса
Муравьева Н.А. –учитель химии
МОУ «Арбузовская сош»
Слайд 2

Описание слайда:
Химическая реакция характеризуется качественным и количественным составом
Каковы массовые отношения?
2H2 + O2 = 2H2O
4 а.е.м. 32 а.е.м. 36 а.е.м.
Каковы отношения числа частиц?
2H2 + O2 = 2H2O
2 молекулы 1 молекула 2 молекулы
Слайд 3

Описание слайда:
Если химическую реакцию рассматривать с точки зрения числа частиц (атомов, молекул) то применяют физическую величину «количество вещества»
- «НЮ» ( моль)
Слайд 4

Описание слайда:
Расскажу сегодня, что ли,
О зловредной роли моли.
Моль съедает шерсть и мех –
Просто паника у всех….
Ну а в химии – изволь!
Есть другое слово “моль”
Прост, как небо и трава,
Моль любого вещества.
Но трудна его дорога:
В моле так частичек много!
Расскажу сегодня, что ли,
О зловредной роли моли.
Моль съедает шерсть и мех –
Просто паника у всех….
Ну а в химии – изволь!
Есть другое слово “моль”
Прост, как небо и трава,
Моль любого вещества.
Но трудна его дорога:
В моле так частичек много!
Слайд 5

Описание слайда:
Моль – единица количества вещества
Моль – это количество вещества, содержащее столько же частиц (атомов, молекул), сколько содержится атомов углерода в 12 г углерода.
Слайд 6

Описание слайда:
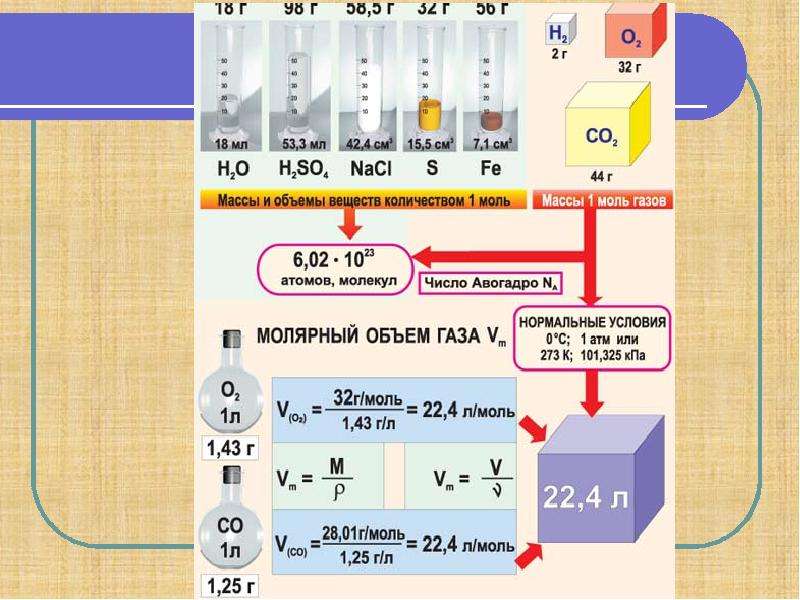
1 моль любого вещества содержит
6,02 . 1023 молекул, атомов или других частиц.
6,02 . 1023 - Число Авогадро
Слайд 7
Слайд 8

Слайд 9

Слайд 10

Описание слайда:
Молярная масса вещества – это масса 1 моля вещества
m
M (г/моль)
Слайд 11

Описание слайда:
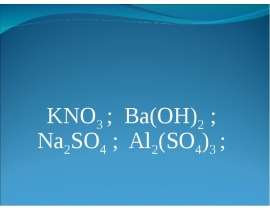
1. Имеется 3 моль азотной кислоты. Сколько молекул азотной кислоты в этой порции?
1. Имеется 3 моль азотной кислоты. Сколько молекул азотной кислоты в этой порции?
2. Какое количество вещества составляют
а) 3 x 1023 атомов серы;
б)12 x 1023атомов серы?
3) В какой порции углекислого газа и во сколько раз больше молекул?
а) 1 моль и 0,5 моль;
б) 0,5 моль и 0,25 моль?
Слайд 12

Описание слайда:
Решить задачи:
№1
Дано: n(Fe2O3) = 1,5 моль
n (PCl3) = 0,5 моль
________________
N (Fe2O3) - ?
N (PCl3) - ?
Слайд 13

Описание слайда:
№2
Дано: N (MgO) = 18 x 1023
N (S) = 3 x 1023 ______________________
n (MgO) - ?
n (S) - ?
Презентацию на
тему Количество вещества. Молярная масса можно скачать бесплатно ниже: