Готовые презентации на тему:
- Образование
- Искусство и Фото
- Наши презентации
- Авто/мото
- Технологии
- Бизнес и предпринимательство
- Карьера
- Данные и аналитика
- Дизайн
- Устройства и комплектующие
- Экономика и Финансы
- Машиностроение
- Развлечения и Юмор
- Путешествия
- Eда
- Политика
- Юриспруденция
- Здоровье и Медицина
- Интернет
- Инвестиции
- Закон
- Стиль жизни
- Маркетинг
- Мобильные технологии
- Новости
- Недвижимость
- Рекрутинг
- Розничная торговля
- Таможня, ВЭД, Логистика
- Наука
- Услуги
- Программное обеспечение
- Спорт
- Музыка
- Шаблоны презентации
- Детские презентации
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- История
- Литература
- Информатика
- Математика
- Обществознание
- Русский язык
- Физика
- Философия
- Химия
- МХК
- ОБЖ
- Окружающий мир
- Педагогика
- Технология
- Начальная школа
- Раскраски для детей
- Товароведение
- Менеджмент
- Страхование









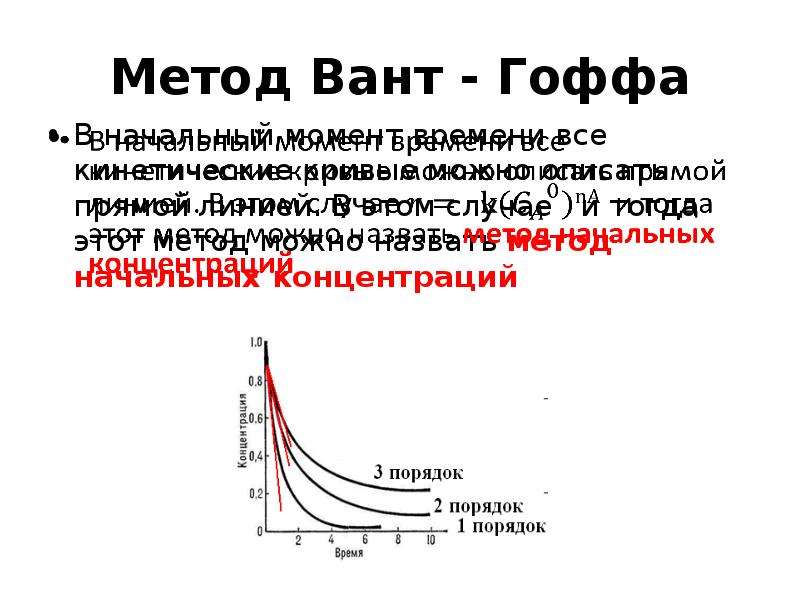
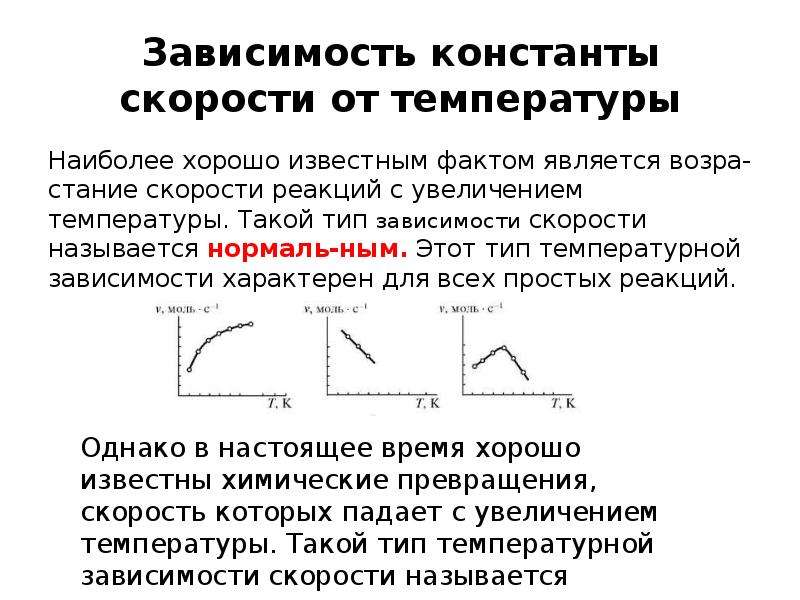
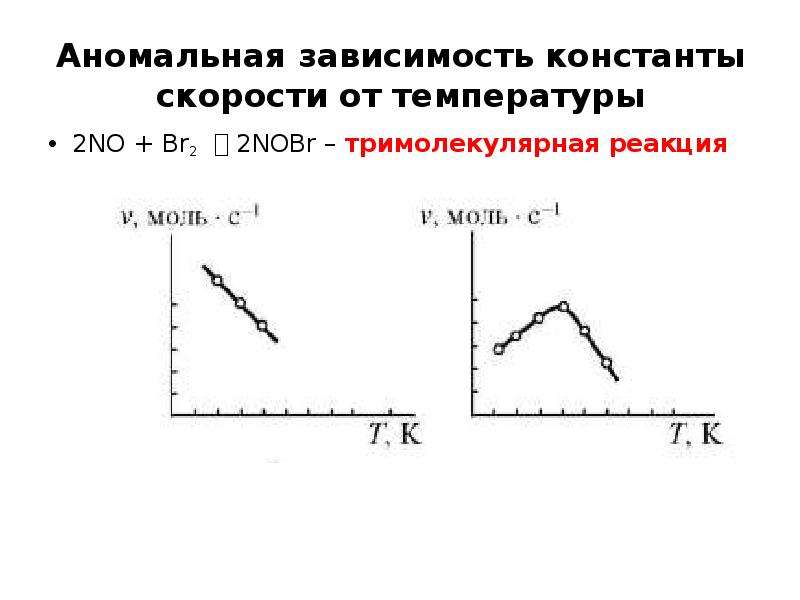


![Уравнение Аррениуса
k = A* или , где
k - константа скорости; R = 8,314 [Дж/моль K]
A - предэкспоненциальный множитель
Ea - энергия активации [Дж/моль]
Множитель A пропорционален общему числу соударений между молекулами в единицу времени. Его размерность совпадает с размерностью константы скорости и, следовательно, А зависит от суммарного порядка реакции.
Экспонента равна доле активных соударений от их общего числа, т.е. столкнувшиеся молекулы должны иметь достаточную энергию взаимодействия.](/documents_6/6e4332368e8a360375668337961bb365/img13.jpg)





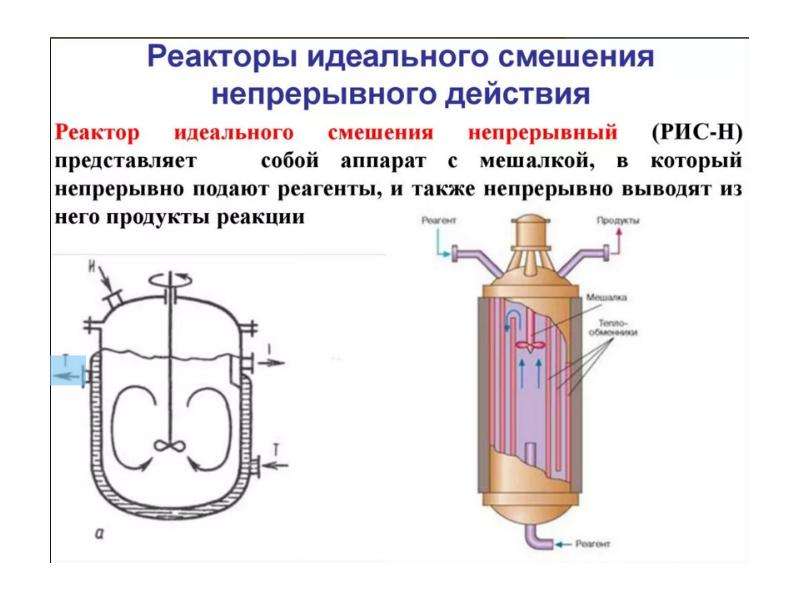














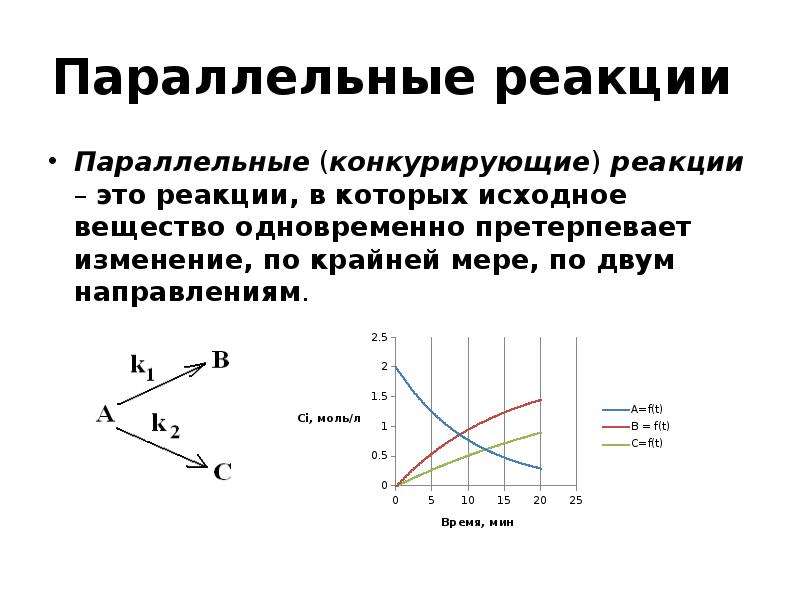

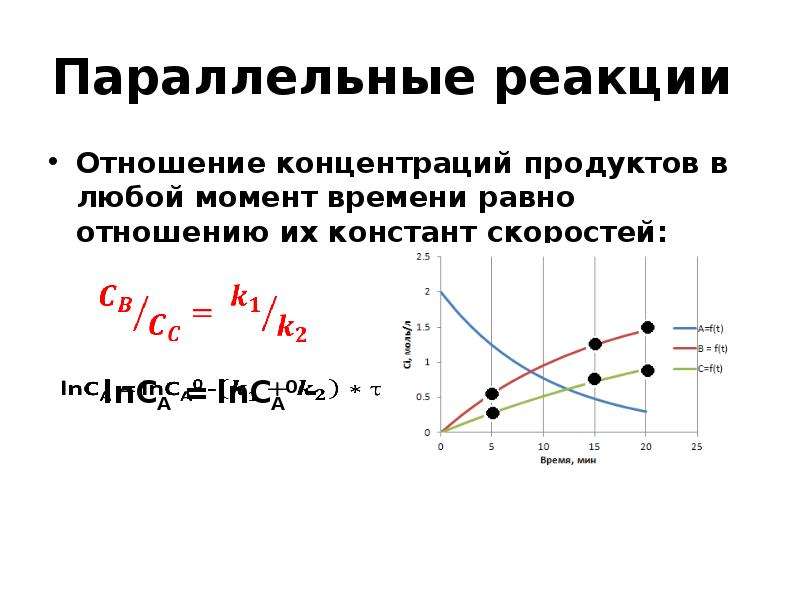




![Вывод уравнения
+ k2CP= k1
=
= -]](/documents_6/6e4332368e8a360375668337961bb365/img41.jpg)
![Итоги
=exp(-k1)
= -]
= + + = - -
= - -
= [1- - -)]](/documents_6/6e4332368e8a360375668337961bb365/img42.jpg)
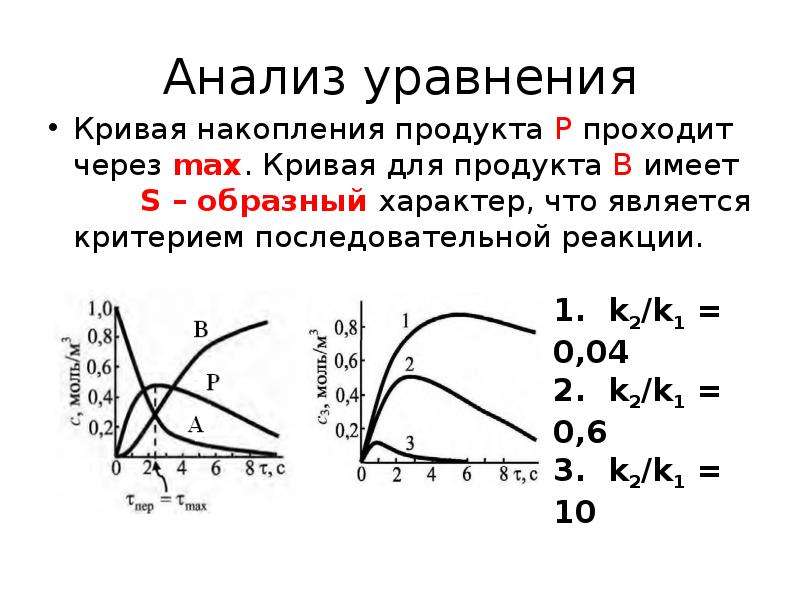
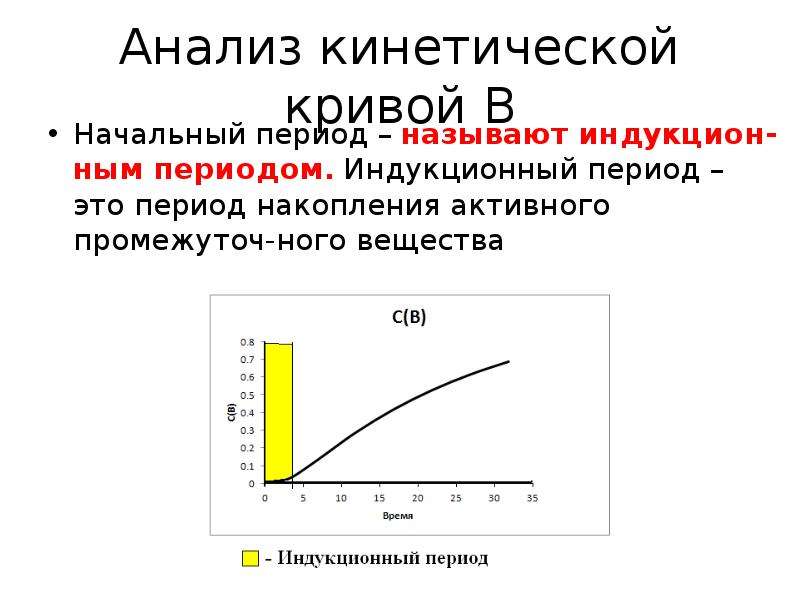

![Выводы
= Подставим в
]
Значение уменьшается с ростом
Продукт Р высокореакционная частица
Время достижения max уменьшается с ростом](/documents_6/6e4332368e8a360375668337961bb365/img46.jpg)


































