Слайды и текст этой презентации
Слайд 1

Слайд 2

Описание слайда:
Ваша цель:
1.Познакомиться с молярным объемом газов;
2. Изучить основные законы химии: закон Авогадро, закон Гей – Люссака;
3. Научится решать типовые задачи;
Слайд 3

Описание слайда:
Девиз урока:
У пространства нет размера, а у знаний нет предела!
Слайд 4

Описание слайда:
Проверка домашнего задания:
Слайд 5

Описание слайда:
1. Что такое стехиометрия?
Слайд 6

Описание слайда:
2. С какими законами вы познакомились на прошлом уроке?
Слайд 7

Описание слайда:
3. В чем заключается сущность закона сохранения массы веществ?
Слайд 8

Описание слайда:
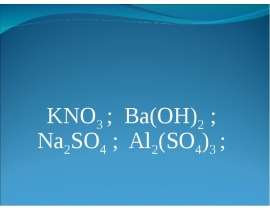
4. Сформулируйте закон постоянства состава и укажите, для каких веществ он всегда строго выполняется?
Слайд 9

Описание слайда:
5. Что такое массовая доля и как она рассчитывается?
Слайд 10

Описание слайда:
1. Газовое состояние вещества:
Слайд 11

Описание слайда:
Вопрос:
В каких агрегатных состояниях могут находится вещества?
Слайд 12
Слайд 13
Описание слайда:
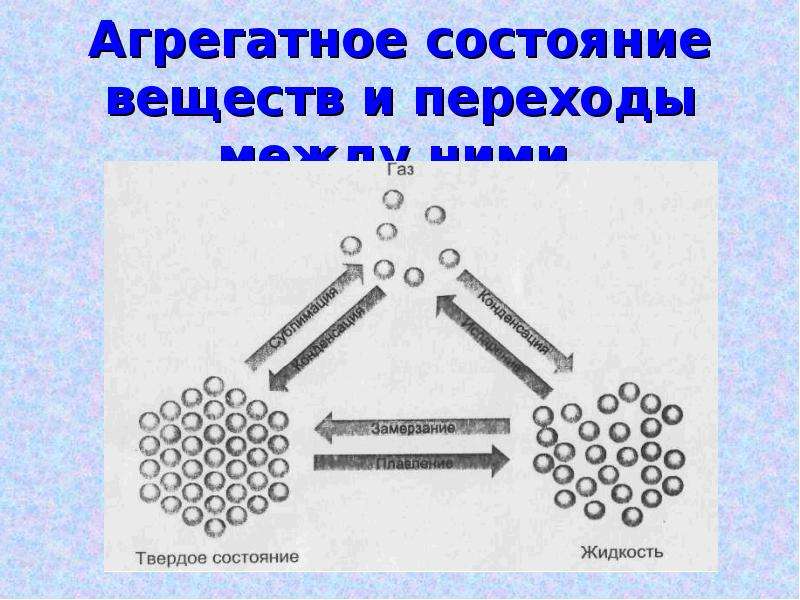
Агрегатное состояние веществ и переходы между ними
Слайд 14

Описание слайда:
2. Закон Авогадро:
Слайд 15

Описание слайда:
Амедео Авогадро
высказал предположение в 1811 году, что
в одинаковых объемах различных газов находится одно и тоже число молекул.
Позже эта гипотеза стала законом Авогадро.
Слайд 16

Описание слайда:
Закон Авогадро:
В равных объемах различных газов при одинаковых условиях (температура, давление) содержится одинаковое число молекул.
Слайд 17

Описание слайда:
Первое следствие из закона Авогадро:
Одинаковое число молекул различных газов при одинаковых условиях занимают одинаковый объем.
Слайд 18

Описание слайда:
3. Молярный объем газов:
Слайд 19

Описание слайда:
Молярный объем газа Vm — величина, определяемая отношением объема данной порции газа V к химическому количеству вещества n в этой порции:
Слайд 20

Описание слайда:
Нормальные условия:
температура — 0°С
давление — 101,325 кПа
Слайд 21

Описание слайда:
Молярный объем любого газа при нормальных условиях:
Второе следствие из закона Авогадро
Слайд 22

Описание слайда:
Вычисление по уравнению реакции объема газа по известному химическому количеству одного из веществ
Слайд 23

Описание слайда:
Задача:
Какой объем водорода (н. у.) можно получить при действии соляной кислоты HCl на цинк химическим количеством 0,5 моль?
Слайд 24

Описание слайда:
4. Закон объемных отношений (закон Гей-Люссака):
Слайд 25

Описание слайда:
Гей-Люссак (1778-1850)
При неизменных температуре и давлении объемы
вступающих в реакцию газов относятся друг к другу,
а также к объемам образующихся газообразных продуктов
как небольшие целые числа.
Слайд 26

Описание слайда:
Расчет объемных отношений газов по химических уравнениям
Слайд 27

Описание слайда:
Обобщение
Объем газов определяется не размером молекул, а расстоянием между ними, которые при одинаковых условиях для всех газов примерно одинаковы.
Слайд 28

Описание слайда:
Задача:
Найдите V хлора который потребуется для получения 80 г хлороводорода? какой V азота имеет такую же массу, что и 40,32 л NH3 (н.у.)?
Слайд 29

Описание слайда:
В равных объемах различных газов при одинаковых условиях (давление, температура) содержится одинаковое число молекул.
Слайд 30

Описание слайда:
Молярный объем газа есть объем его порции химическим количеством 1 моль. При нормальных условиях (температура 0°С и давление — 101,325 кПа) молярный объем любого газа является величиной постоянной, равной 22,4 дм3/моль.
Слайд 31

Описание слайда:
Коэффициенты перед газообразными веществами в уравнениях химических реакций соответствуют объемным отношениям этих веществ.
Слайд 32

Описание слайда:
Закрепление
Какой V (при н. у.) занимают (I вариант) – любой газ химическим количеством 2 моль, (II - вариант) – азот массой 2 г.
Слайд 33

Описание слайда:
I вариант
Какой объем углерод (IV) – оксида можно получить действием избытка разбавленной серной кислоты на натрий-карбонат химическим количеством 0,35 моль?
II вариант
Какой объем кислорода потребуется для полного сжигания 200 дм3 (при н.у.) метана и какой объем углерод (IV)-оксида при этом образуется?
Слайд 34

Описание слайда:
Оцените своё состояние после урока
Слайд 35

Описание слайда:
Домашнее задание:
§ 5 стр. 29-32, 35-37. Упр. 1-7, 12.
Слайд 36

Описание слайда:
Спасибо за внимание!
Презентацию на
тему Законы газового состояния вещества можно скачать бесплатно ниже: