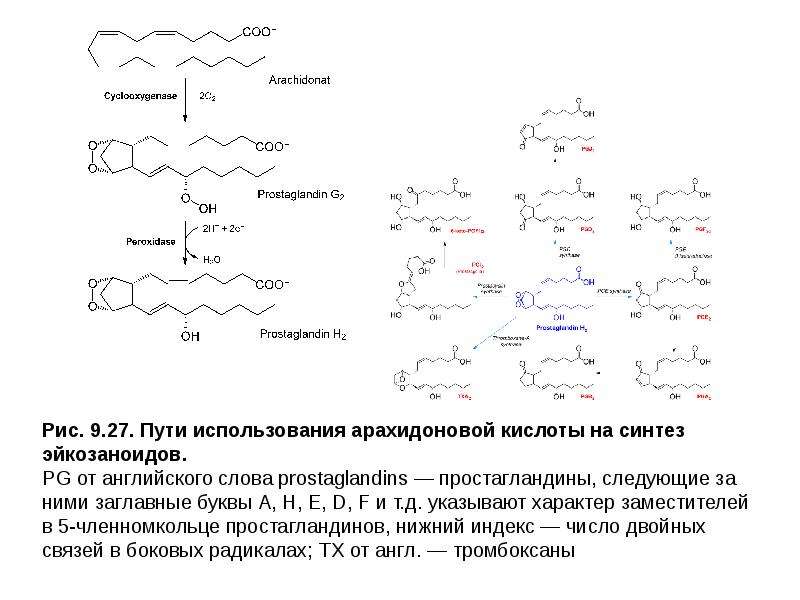
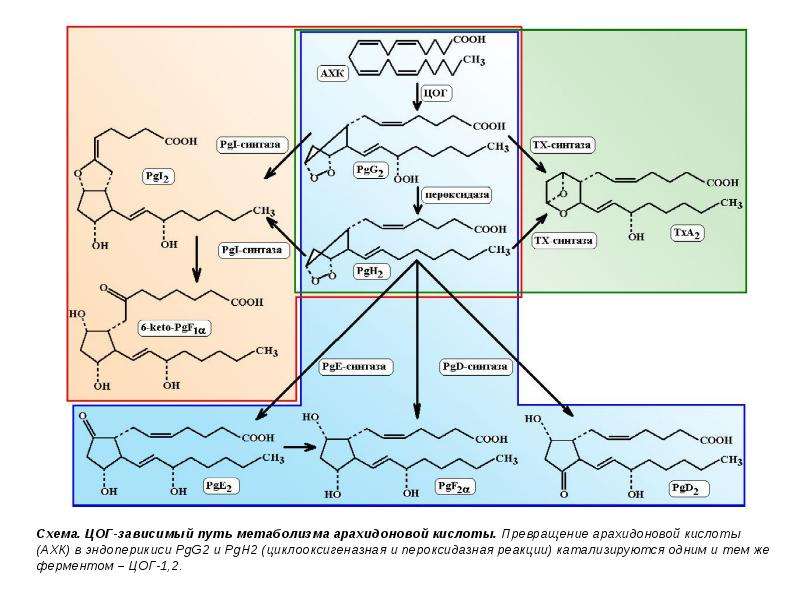
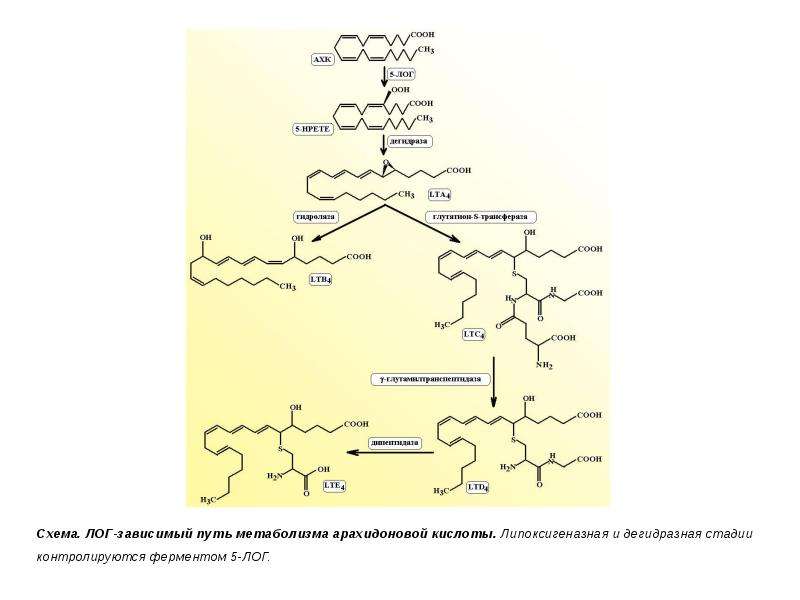
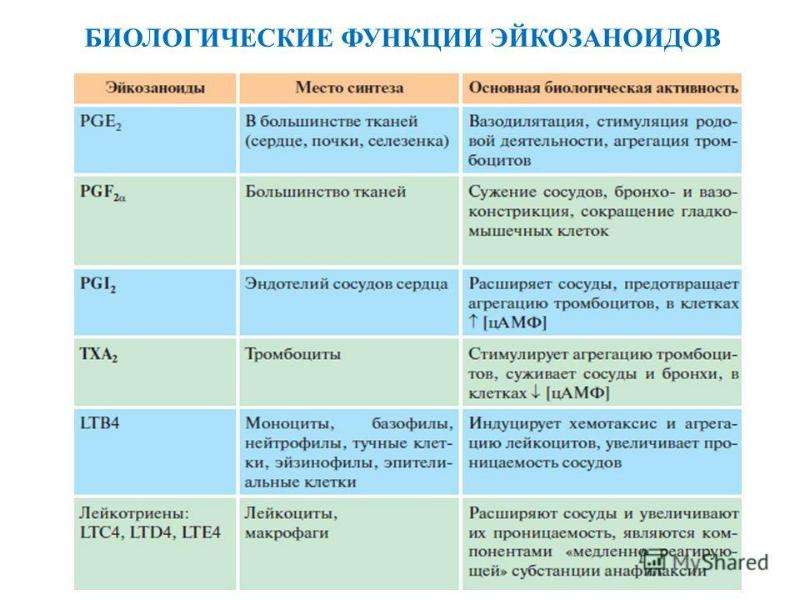
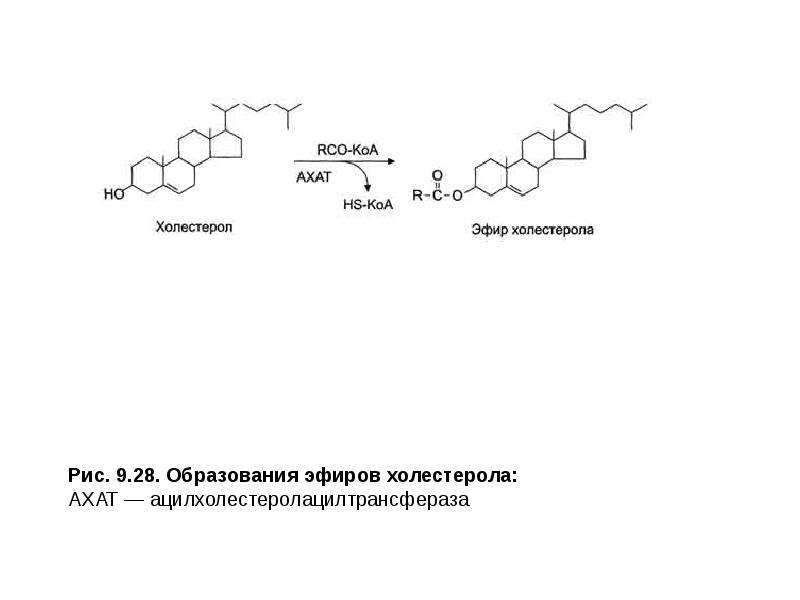
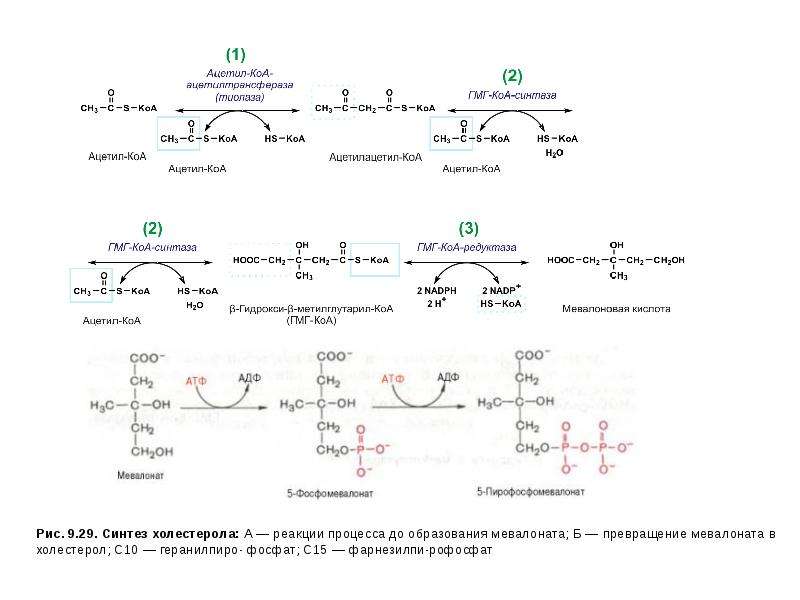
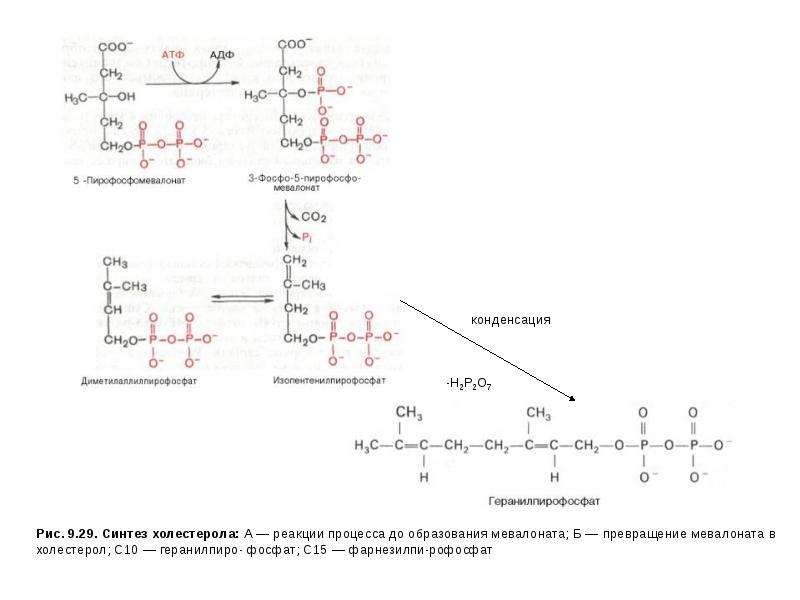
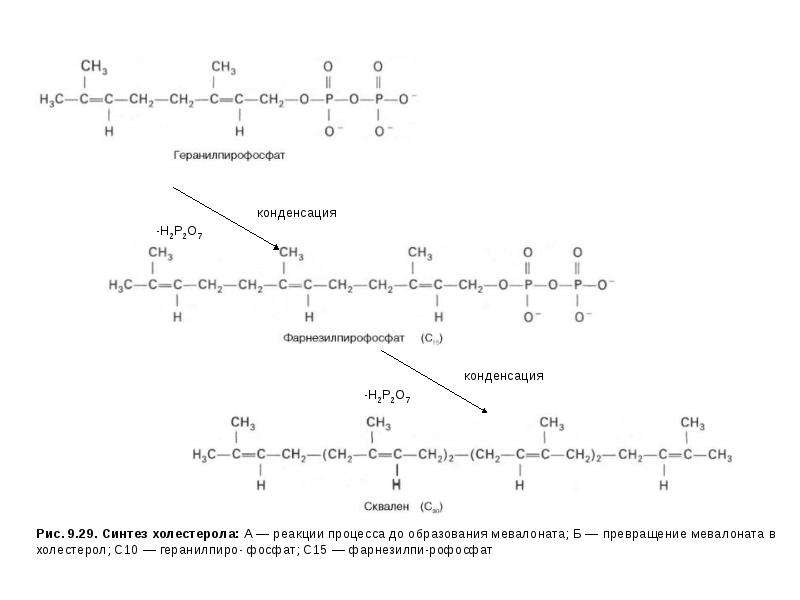
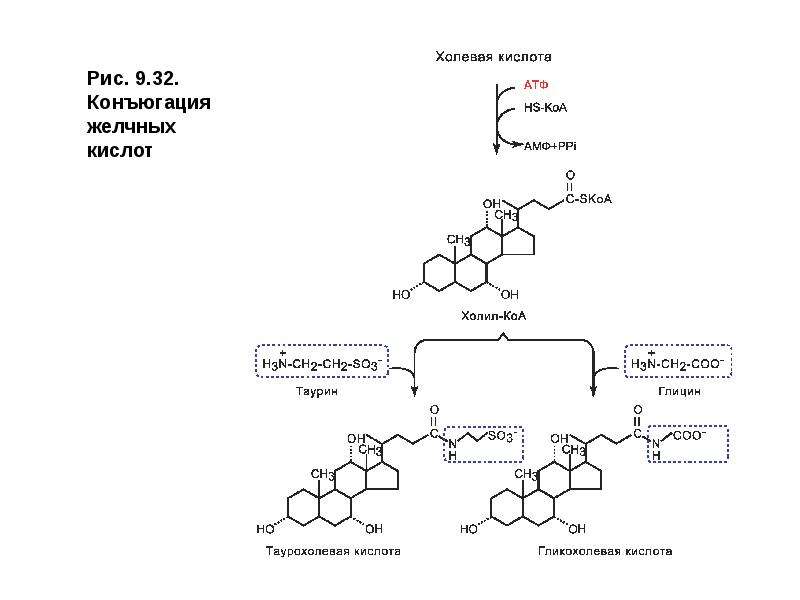
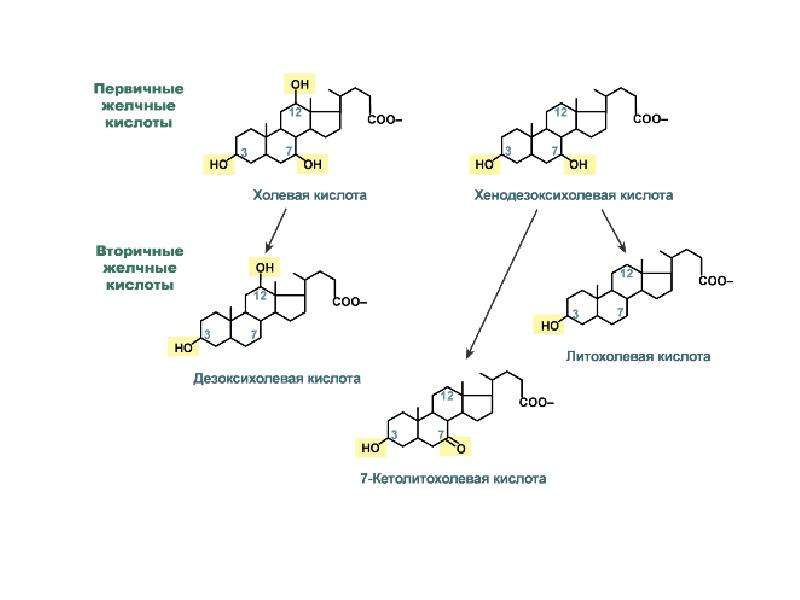
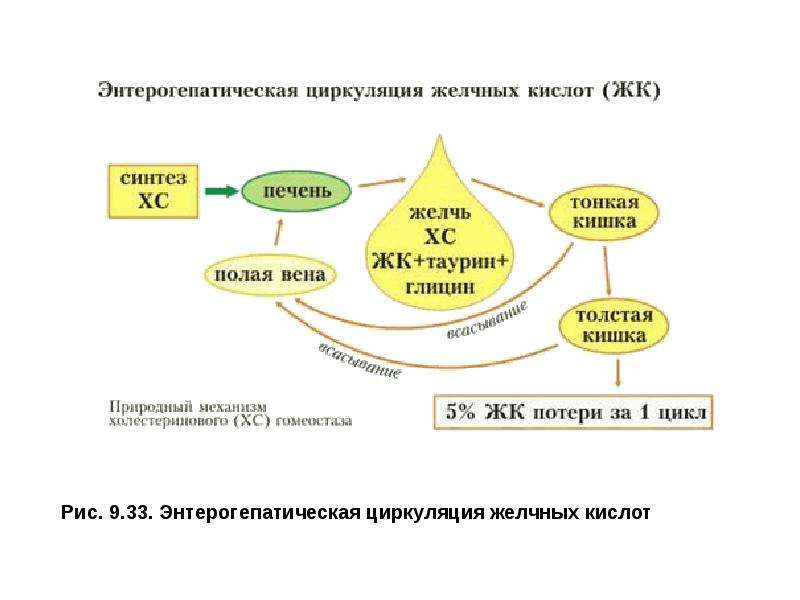
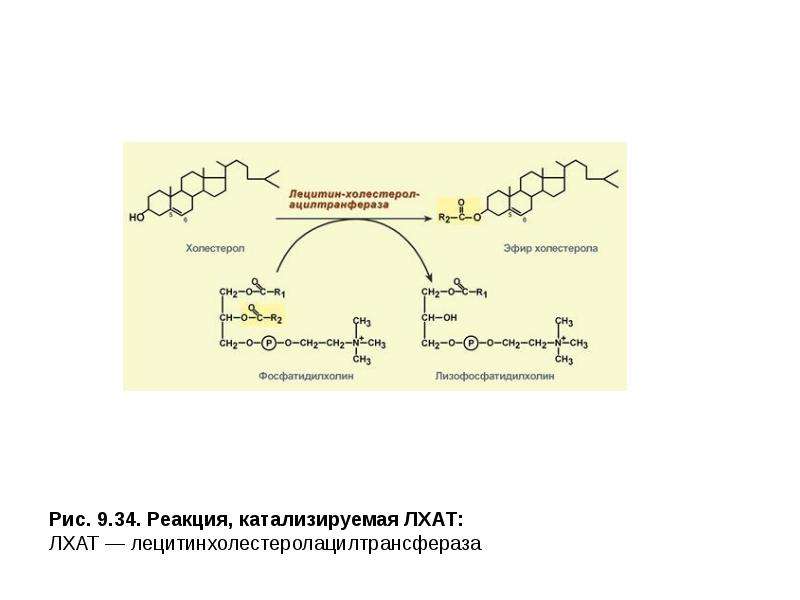
Описание слайда:
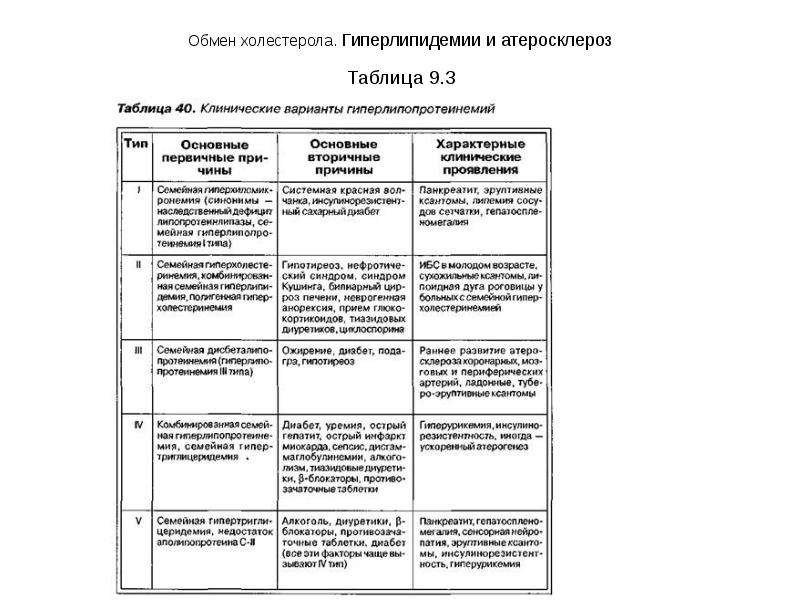
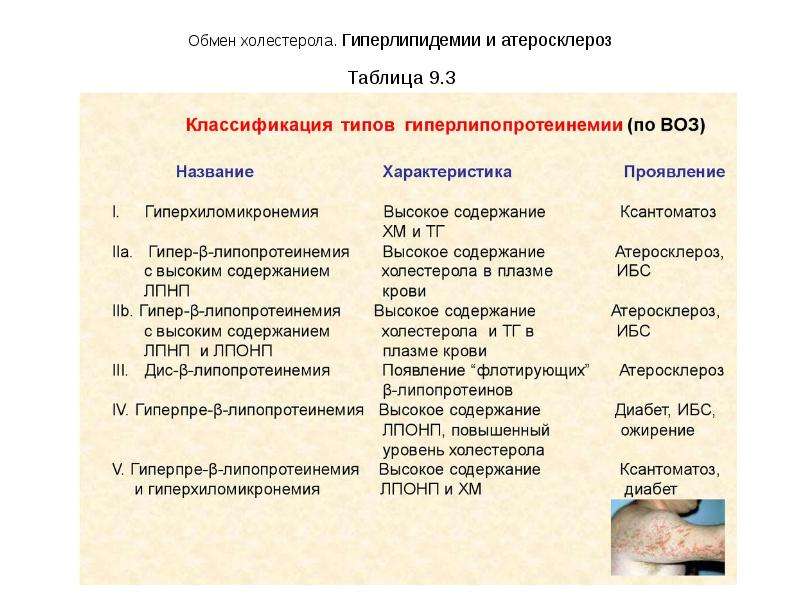
Обмен холестерола. Гиперлипидемии и атеросклероз
перекисного окисления ненасыщенных жирных кислот в составе фосфолипидов мембран активными формами кислорода ( О2-· ,Н2О2, ОН·);
•денатурации или частичного протеолиза белковой части;
•гликозилирования белков;
•десиалирования гликопротеинов мембран путем отщепления концевых остатков сиаловой кислоты от олигосахаридных цепей;
•образования комплексов между измененными ЛП и антителами.
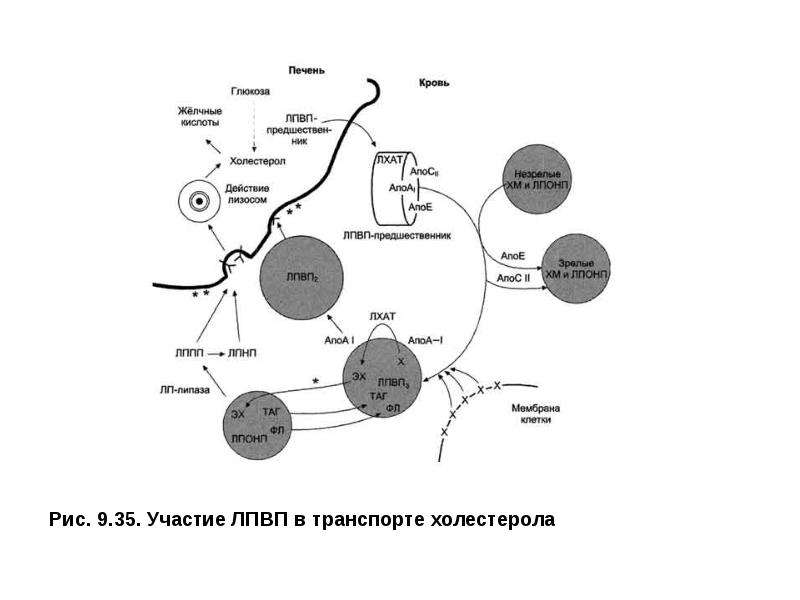
В результате длительной циркуляции по крови образуются множественно модифицированные ЛПНП (ммЛПНП), которые удаляются из кровотока с помощью макрофагов, имеющих на мембране рецепторы к измененным компонентам крови —скавенджер-рецепторы.Макрофаги, накапливая липиды, превращаются в «пенистые клетки», содержащие капли ЭХс в цитоплазме. Они проходят под слой эндотелия, причем наиболее интенсивно в области поврежденного эндотелия. Сюда же поступают тромбоциты. Макрофаги и тромбоциты выделяют цитокины, стимулирующие пролиферацию и миграцию гладкомышечных клеток во внутреннюю оболочку сосуда.
Атеросклеротические бляшки представляют собой скопления ЭХс и остатков разрушенных клеток, окруженные капсулой, которую образуют гладкомышечные клетки из медии артериальной стенки. Между бляшками артерий и ЛП крови происходит постоянный обмен холестеролом. Бляшки могут изъязвляться, кальцифицироваться, вызывая сужение и нарушение моторики сосудов, вплоть до полной их закупорки. Это становится причиной ишемической болезни сердца, инфарктов миокарда, инсультов, облитерирующего эндоартериита.
Методы лечения и профилактики атеросклероза направлены на усиление оттока Хс из сосудов в ЛП. С этой целью назначают:
•диету, содержащую мало Хс;
•ингибиторы ПОЛ, например витамины Е,С, А, обладающие антиоксидантными свойствами;
•препараты, содержащие ω-3-полиненасыщенныежирные кислоты, которые препятствуют тромбообразованию и способствуют выведению Хс из организма;
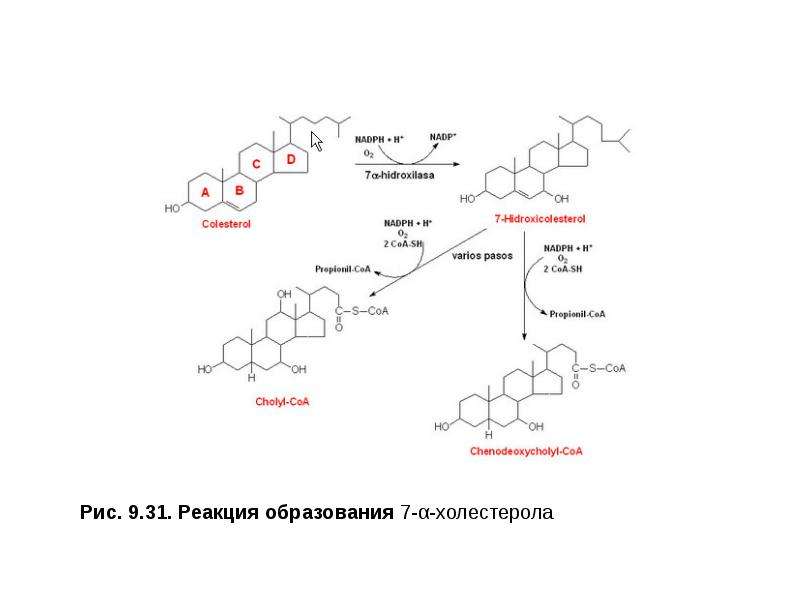
•секвестранты — вещества, связывающие в кишечнике желчные кислоты и усиливающие их выведение из организма;
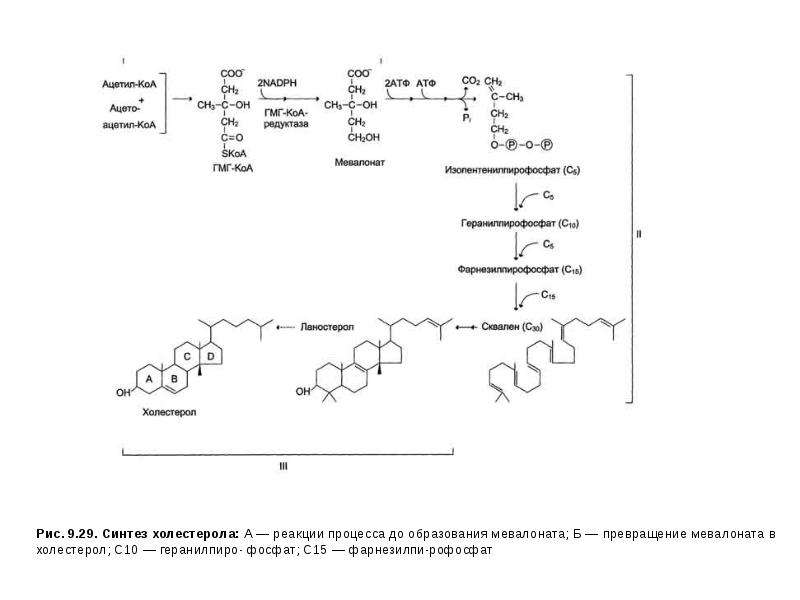
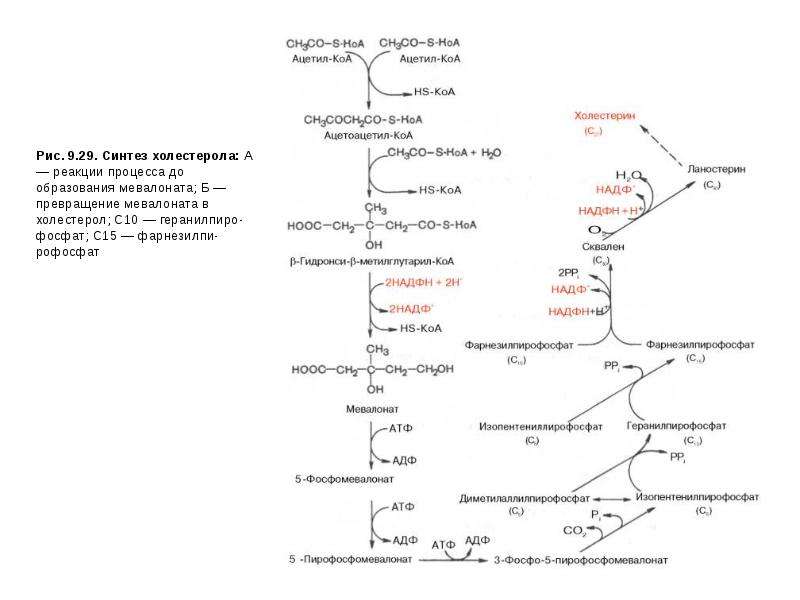
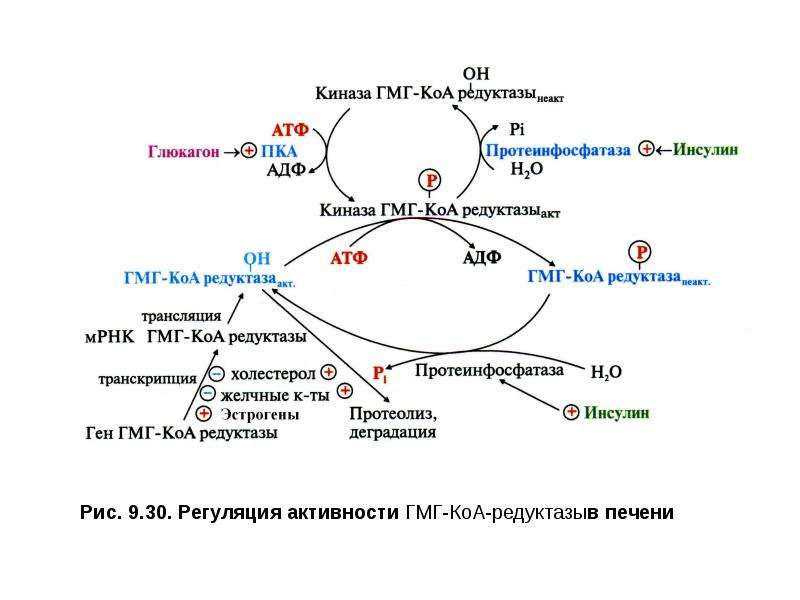
•ингибиторы ГМГ-КоА-редуктазы— регуляторного фермента синтеза Хс (мевакор, ловастатин, правастатин и др.);
•фибраты (клофибрат, фенофибрат и др.), активирующие ЛП-липазуи снижающие образование ЛПОНП.
В тяжелых случаях применяют сорбционные методы.