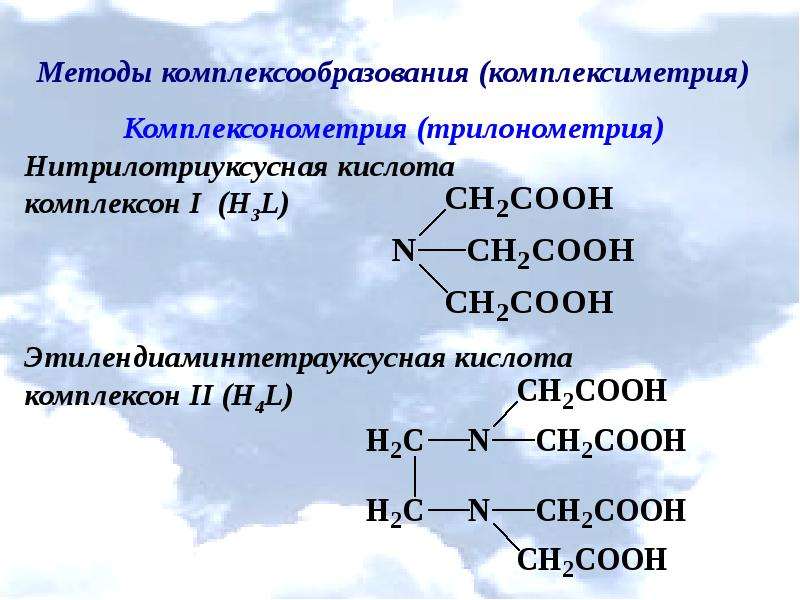
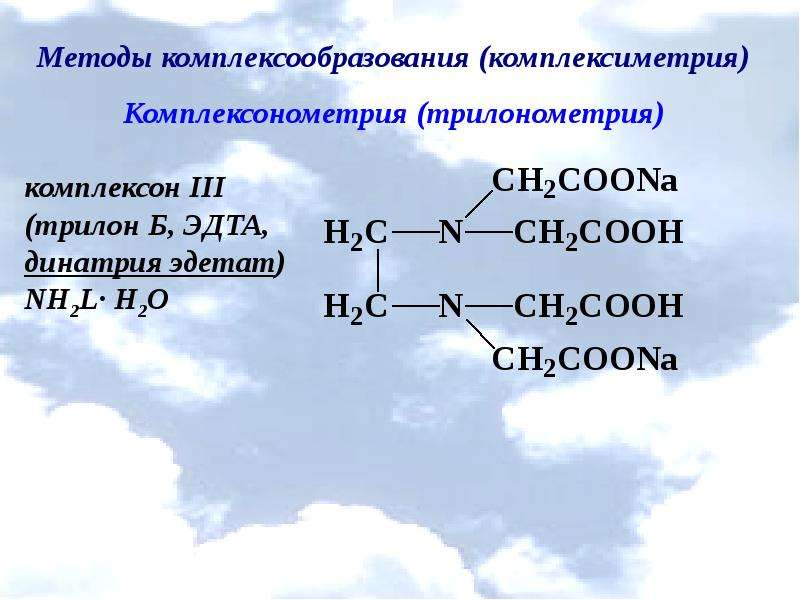
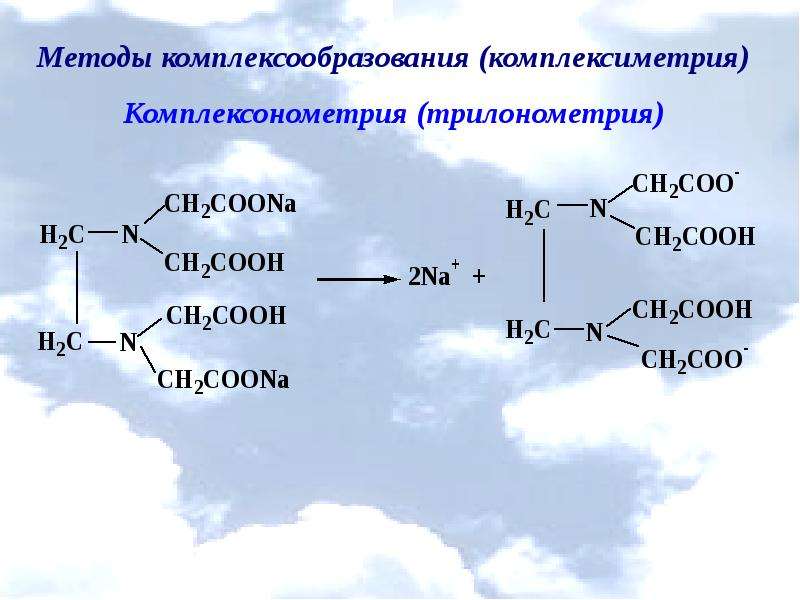
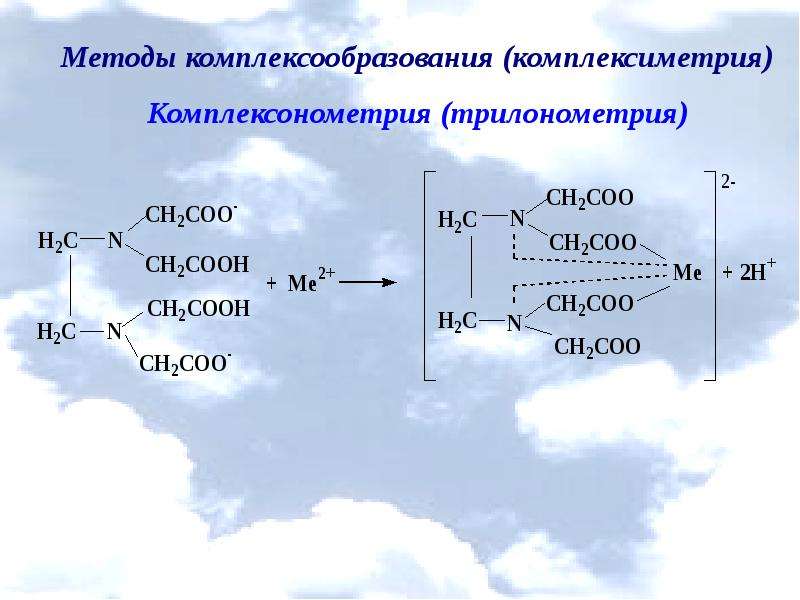
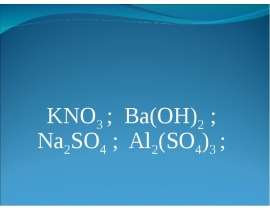
Описание слайда:
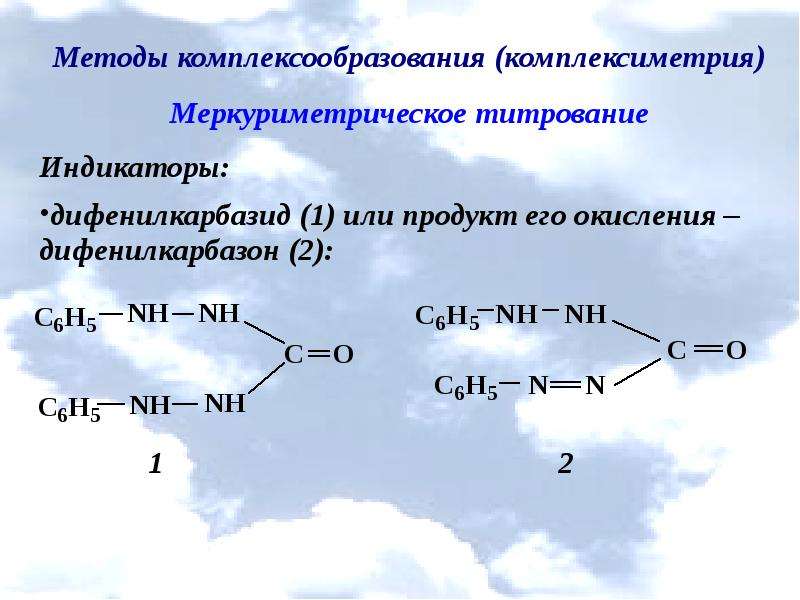
дифенилкарбазон (1% раствор в 95% спирте), адсорбционный индикатор. Его применение основано на том, что после полного осаждения галогенид-ионов, избыточная капля титранта реагирует с дифенилкарбазоном и образует в нейтральной или слабокислой средах осадок синего цвета, а в сильнокислой среде раствор синего цвета, в конечной точке титрования окраска становится сине-фиолетовой. При титровании с дифенилкарбозоном вначале проводят грубое титрование с точностью до 1,0 см3, а затем при повторном точном титровании чтобы уменьшить ошибку за счет адсорбции индикатор вводят в раствор, когда остается добавить 1,0-2,0 см3 титранта. Поправка на индикатор в этом случае не нужна. Перед железа (III) тиоционатом индикатор дифенилкарбазон имеет ряд преимуществ, с ним можно титровать: в сильнокислых растворах; в окрашенных и мутных растворах (благодаря тому, что окраска осадка или раствора в конечной точке титрования очень яркая), в присутствии пептизирующих веществ.
дифенилкарбазон (1% раствор в 95% спирте), адсорбционный индикатор. Его применение основано на том, что после полного осаждения галогенид-ионов, избыточная капля титранта реагирует с дифенилкарбазоном и образует в нейтральной или слабокислой средах осадок синего цвета, а в сильнокислой среде раствор синего цвета, в конечной точке титрования окраска становится сине-фиолетовой. При титровании с дифенилкарбозоном вначале проводят грубое титрование с точностью до 1,0 см3, а затем при повторном точном титровании чтобы уменьшить ошибку за счет адсорбции индикатор вводят в раствор, когда остается добавить 1,0-2,0 см3 титранта. Поправка на индикатор в этом случае не нужна. Перед железа (III) тиоционатом индикатор дифенилкарбазон имеет ряд преимуществ, с ним можно титровать: в сильнокислых растворах; в окрашенных и мутных растворах (благодаря тому, что окраска осадка или раствора в конечной точке титрования очень яркая), в присутствии пептизирующих веществ.