Слайды и текст этой презентации
Слайд 1

Описание слайда:
Характеристика элементов VII группы главной подгруппы
Хлор
Выполнила Ширяева София
ХБ-5
Слайд 2
Слайд 3

Слайд 4

Слайд 5
Слайд 6

Описание слайда:
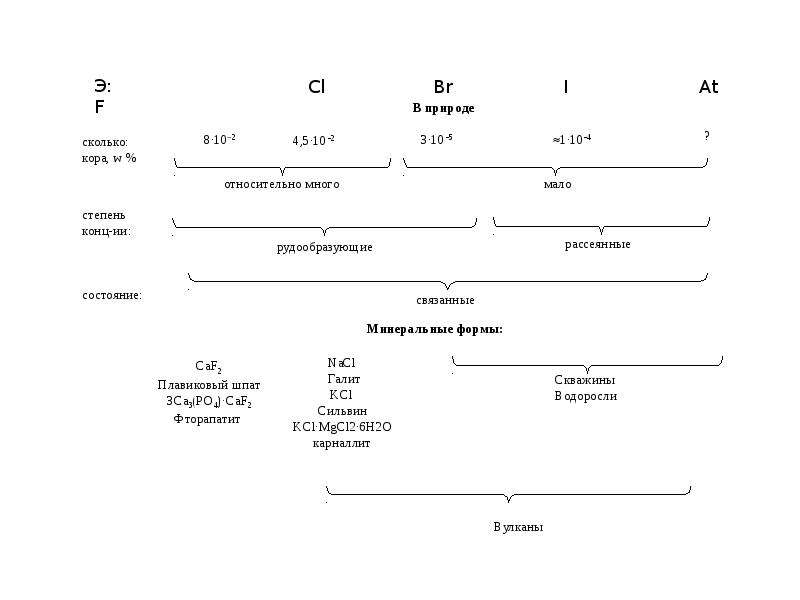
Нахождение в природе
Слайд 7

Слайд 8

Слайд 9

Слайд 10

Слайд 11

Описание слайда:
Характеристика химического элемента
Хлор – элемент VII А группы. Порядковый номер 17
Относительная атомная масса: 35,4527 а. е. м. (г/моль)
Количество протонов, нейтронов, электронов: 17,18,17
Строение атома:
Слайд 12

Описание слайда:
Электронная формула:
Типичные степени окисления: -1, 0, +1, +3, +4, +5, +7
Энергия ионизации: 1254,9(13,01) кДж/моль (эВ)
Сродство к электрону: 349 (кДж/моль)
Электроотрицательность по Полингу: 3,20
Слайд 13

Описание слайда:
Характеристика простого вещества
Тип связи: ковалентная неполярная
Молекула двухатомная
Изотопы: 35Cl (75,78 %) и 37Cl(24,22 %)
Тип кристаллической решетки: молекулярная
Слайд 14
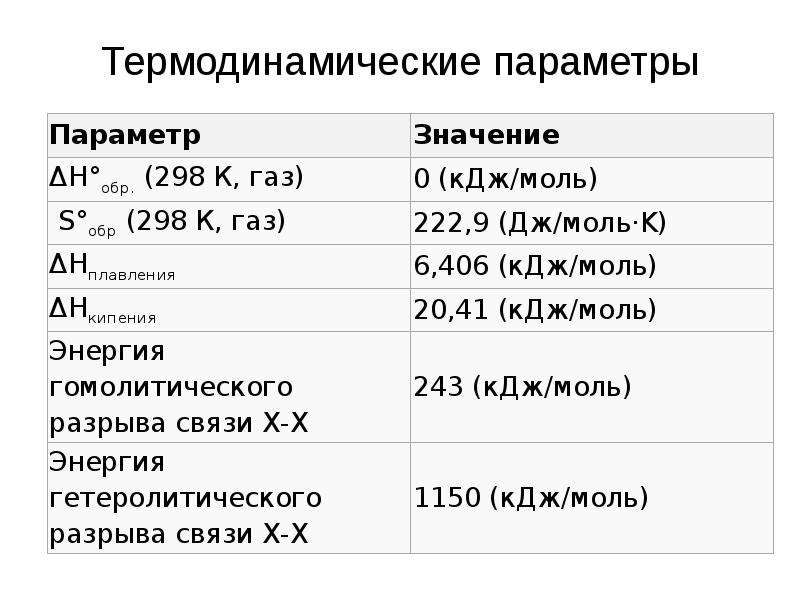
Описание слайда:
Термодинамические параметры
Слайд 15
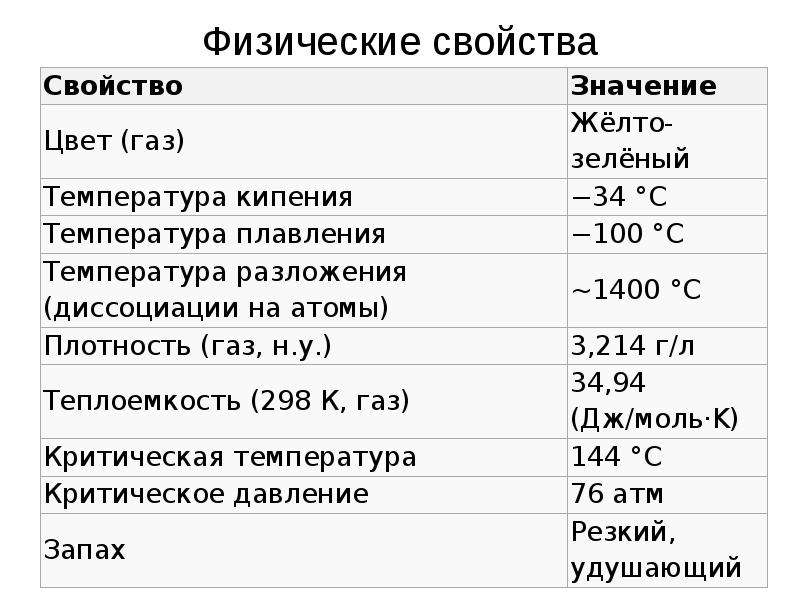
Описание слайда:
Физические свойства
Слайд 16
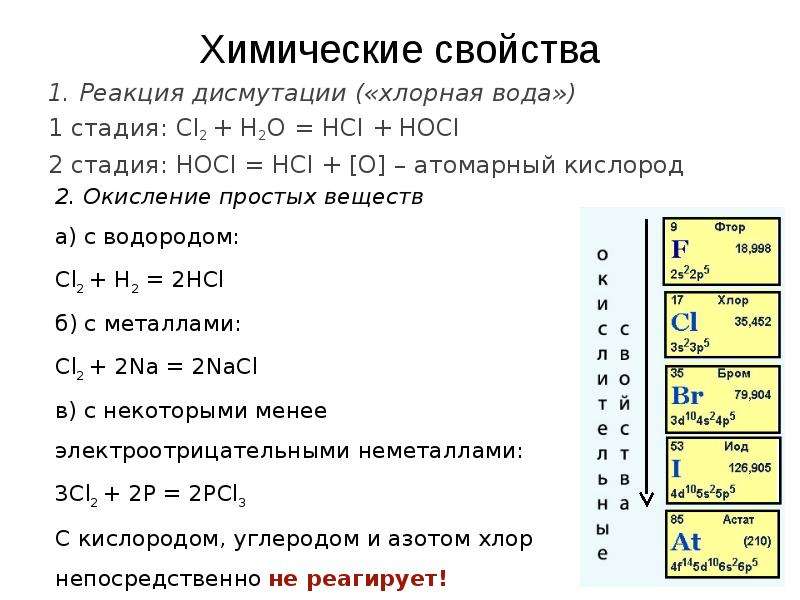
![Химические свойства
1. Реакция дисмутации («хлорная вода»)
1 стадия: Cl2 + H2O = HCl + HOCl
2 стадия: HOCl = HCl + [О] – атомарный кислород](/documents_2/b0410d40c416deb54266ee71b2a0c46f/img15.jpg)
Описание слайда:
Химические свойства
1. Реакция дисмутации («хлорная вода»)
1 стадия: Cl2 + H2O = HCl + HOCl
2 стадия: HOCl = HCl + [О] – атомарный кислород
Слайд 17

Описание слайда:
3. Взаимодействие со сложными веществами
а) с водой: см. выше реакция дисмутации
б) с кислородсодержащими кислотами: не реагирует!
в) с растворами щелочей:
на холоду: Cl2 + 2NaOH = NaCl + NaClO + H2O
при нагревании: 3Cl2+ 6 KOH = 5KCl + KClO3 + 3H2O
д) со многими органическими веществами:
Cl2 + CH4 = CH3Cl + HCl
C6H6 + Cl2 = C6H5Cl + HCl
Слайд 18

Описание слайда:
Важнейшие соединения хлора
Слайд 19

Описание слайда:
Свойства соляной кислоты:
Свойства соляной кислоты:
Очень устойчива к нагреванию
В воде кислота
Слабый окислитель по протону
Под действием сильных окислителей анион окисляется
Слайд 20

Слайд 21
![Смесь 3v HCl : 1v HNO3 называется «царской водкой».
Смесь 3v HCl : 1v HNO3 называется «царской водкой».
Она способна растворять даже золото и платину.
4 H3O+ + 3 Cl− + NO3− = NOCl + Cl2 + 6 H2O
Расстворение идет благодаря высокой концентрации хлорид-ионов :
3 Pt + 4 HNO3 + 18 HCl → 3 H2[PtCl6] + 4 NO↑ + 8 H2O
Для хлороводорода также характерны реакции присоединения к кратным связям (электрофильное присоединение):
R-CH=CH2 + HCl → R-CHCl-CH3
R-C≡CH + 2 HCl → R-CCl2-CH3](/documents_2/b0410d40c416deb54266ee71b2a0c46f/img20.jpg)
Описание слайда:
Смесь 3v HCl : 1v HNO3 называется «царской водкой».
Смесь 3v HCl : 1v HNO3 называется «царской водкой».
Она способна растворять даже золото и платину.
4 H3O+ + 3 Cl− + NO3− = NOCl + Cl2 + 6 H2O
Расстворение идет благодаря высокой концентрации хлорид-ионов :
3 Pt + 4 HNO3 + 18 HCl → 3 H2[PtCl6] + 4 NO↑ + 8 H2O
Для хлороводорода также характерны реакции присоединения к кратным связям (электрофильное присоединение):
R-CH=CH2 + HCl → R-CHCl-CH3
R-C≡CH + 2 HCl → R-CCl2-CH3
Слайд 22
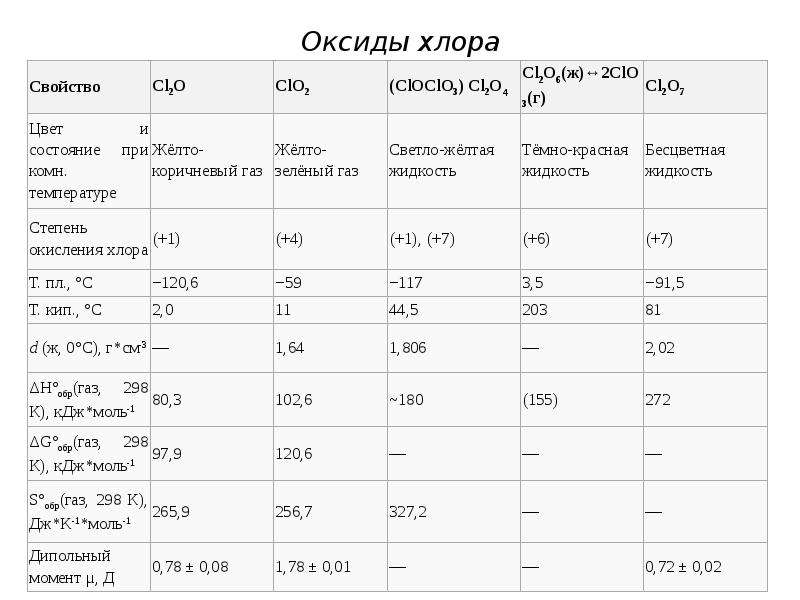
Слайд 23

Описание слайда:
Оксид хлора (I), оксид дихлора, ангидрид хлорноватистой кислоты (Cl2O)
Оксид хлора (I), оксид дихлора, ангидрид хлорноватистой кислоты (Cl2O)
В нормальных условиях представляет собой буровато-жёлтый газ с характерным запахом, напоминающим запах хлора. При температурах ниже 2 °C — жидкость золотисто-красного цвета. Ядовит: поражает дыхательные пути. При больших концентрациях взрывоопасен. Самопроизвольно медленно разлагается:
Кислотный и солеобразующий. Хорошо растворим в воде с образованием слабой хлорноватистой кислоты:
Быстро реагирует со щелочами:
Cl2O + 2NaOH(разб.) = 2NaClO + H2O
Слайд 24

Слайд 25

Описание слайда:
Проявляет окислительно-восстановительные свойства.
Проявляет окислительно-восстановительные свойства.
2ClO2 + 5H2SO4 (разб.) + 10FeSO4 = 5Fe2(SO4)3 + 2HCl + 4H2O
ClO2 + O3 = ClO3 + O2
ClO2 + 2NaOHхол. = NaClO2 + NaClO3 + H2O
ClO2 реагирует со многими с органическими соединениями и выступает окислителем средней силы.
Слайд 26

Слайд 27
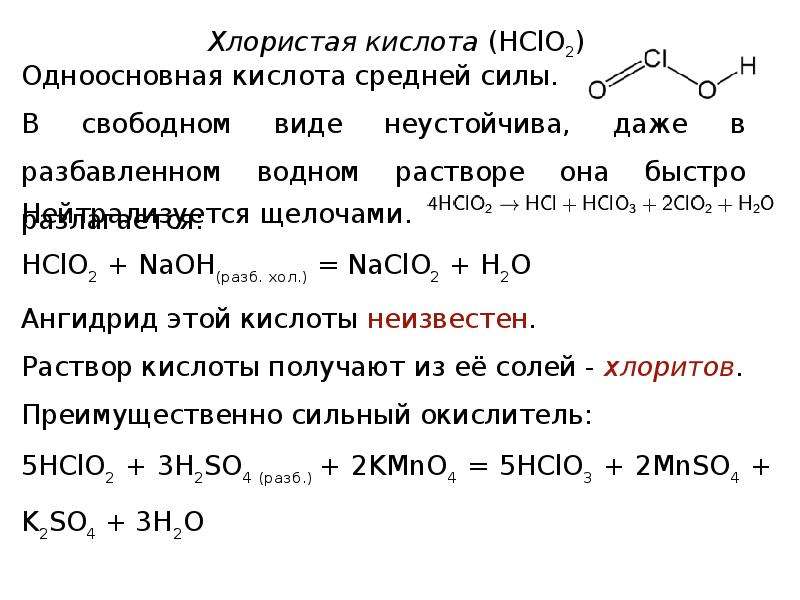
Слайд 28

Слайд 29

Описание слайда:
Получение
Слайд 30

Описание слайда:
Получение
Слайд 31

Описание слайда:
Самые большие запасы хлора содержатся в составе солей вод морей и океанов
Слайд 32
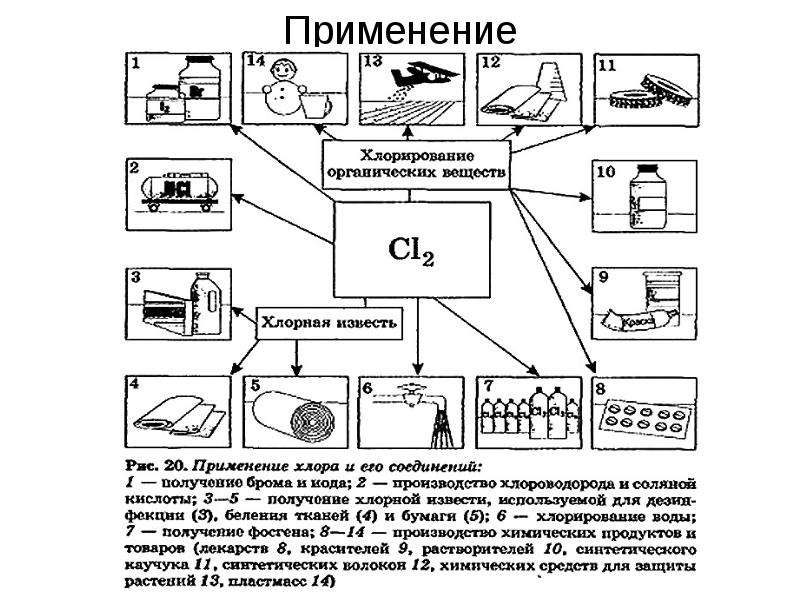
Описание слайда:
Применение
Слайд 33

Описание слайда:
Физиологическое действие
Слайд 34

Слайд 35
Слайд 36

Презентацию на
тему Характеристика элементов VII группы главной подгруппы. Хлор можно скачать бесплатно ниже: