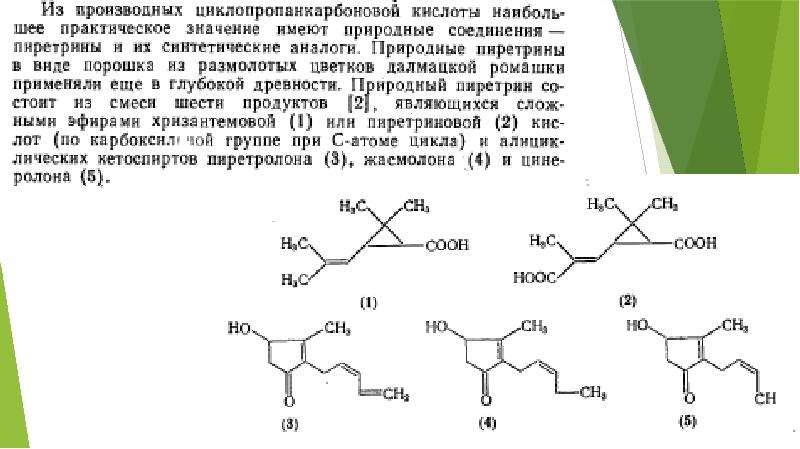
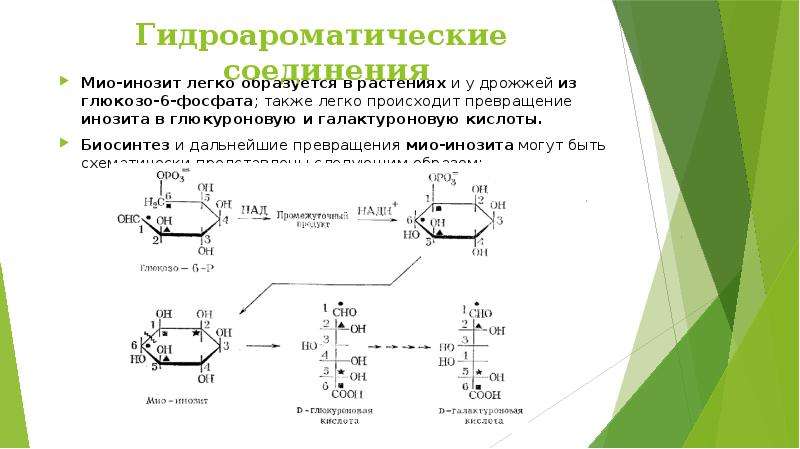
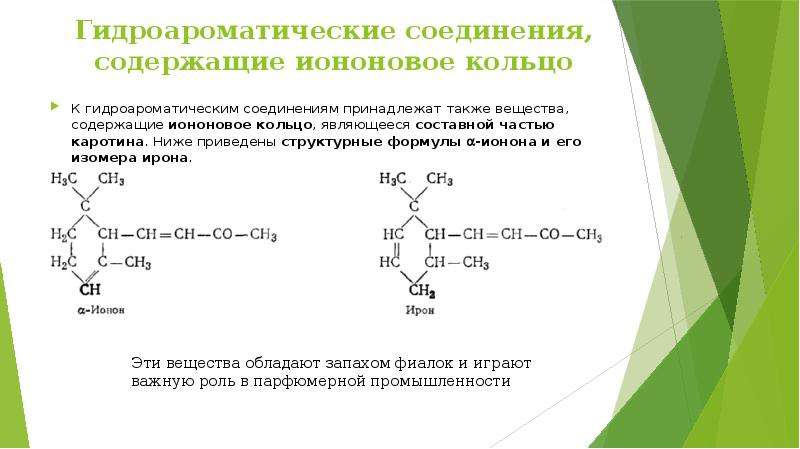
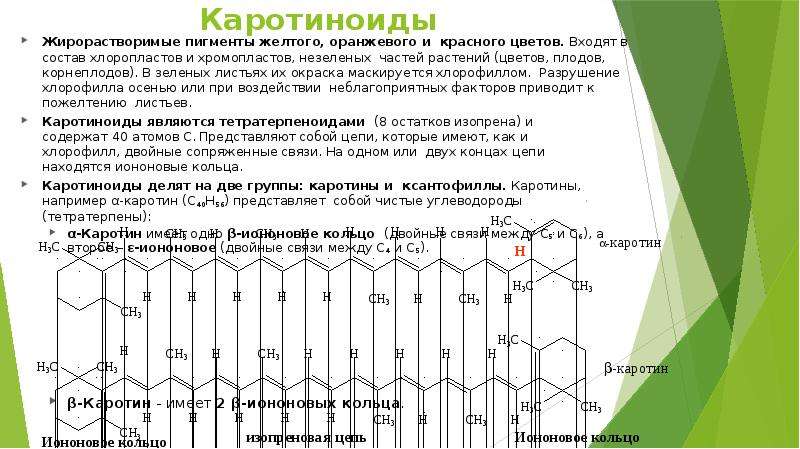
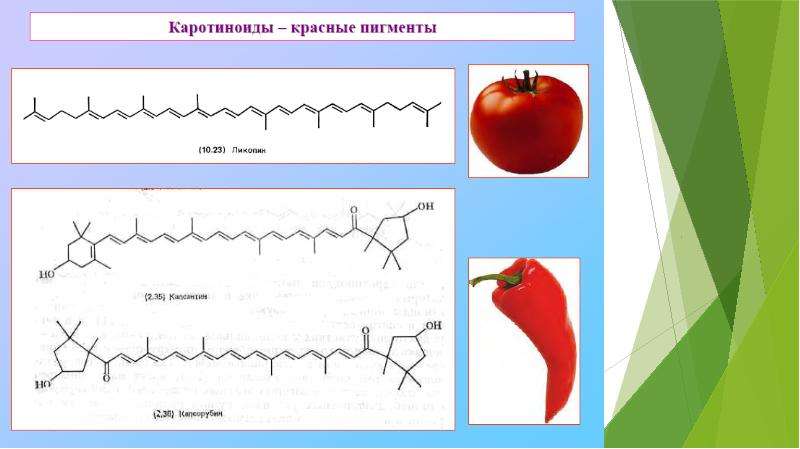
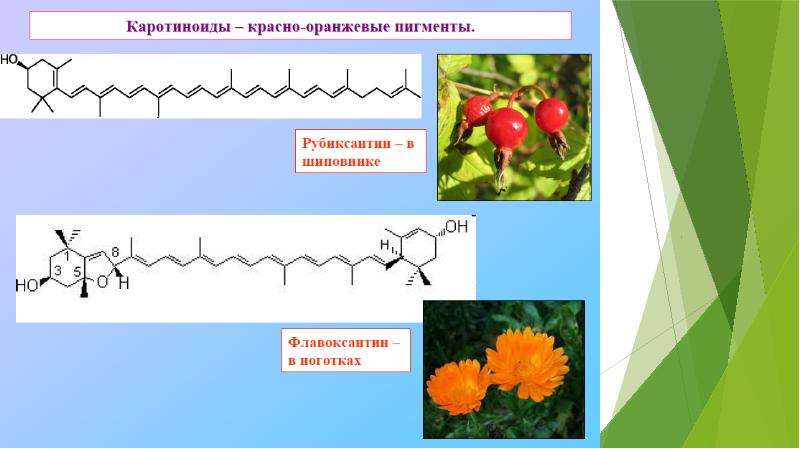
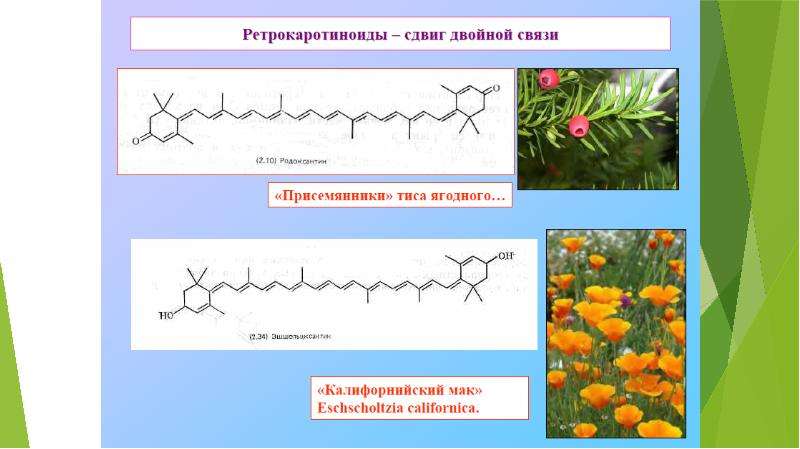
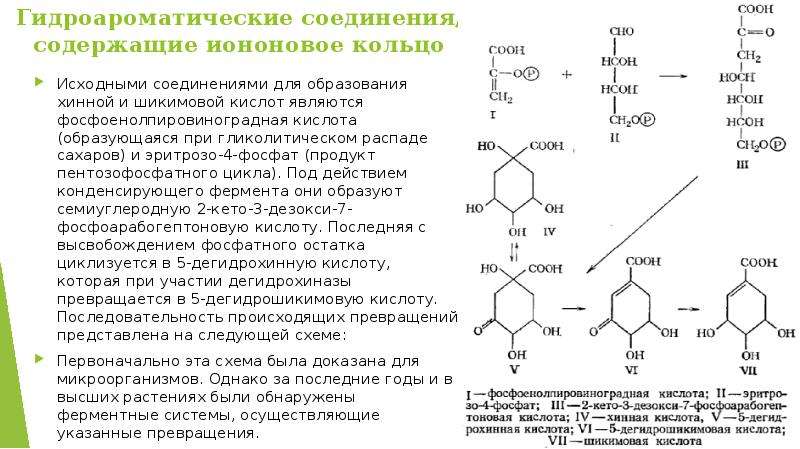
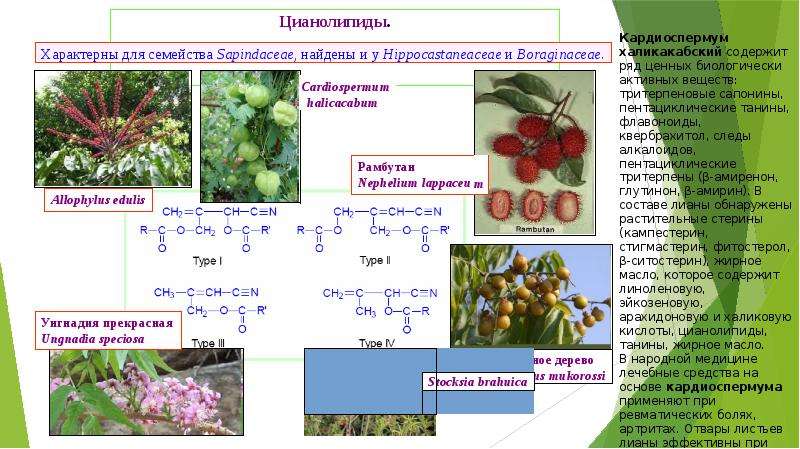
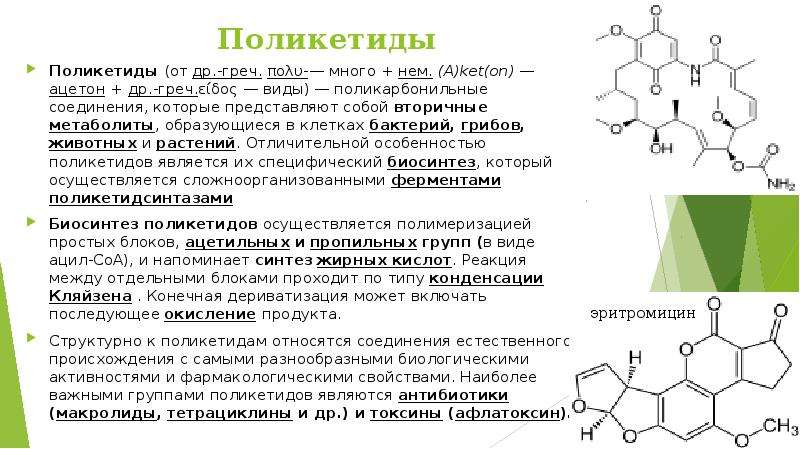
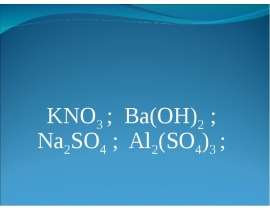
Описание слайда:
Применение в медицине
По некоторым данным, фитин способствует выведению из организма радиоактивного цезия. Однако фитин одновременно связывает кальций и цинк, снижая их содержание в организме. Выпускается в виде одноименного лекарственного препарата, применяемого для стимуляции кроветворения, усиления роста и развития костной ткани, а также при сосудистой гипотонии, неврастении, импотенции, рахите, малокровии, диатезах, скрофулёзе и т. д. Также входит в состав витаминно-минерального комплекса «Д-КАЛЬЦИН» (гранулы, 5 г гранул содержат: фитин — 125 мг, кальция глюконат — 375 мг, витамин Д2 — 3000 МЕ), Гефефитин (таблетки, содержащие 0,375 г сухих дрожжей и 0,125 г фитина) и поливитамина Квадевит.
Витамин В8, мезоинозит, инозит, витамин У — водорастворимый витамин. Участвует в обмене углеводов организма человека, так же метаболизме пуринов, в биосинтезе фосфолипидов, играет роль в холестериновом обмене (способствует снижению уровня холестеринов в сыворотке крови). Он присутствует практически во всех тканях организма и отличается способностью накапливаться в некоторых органах человека в большом количестве (преимущественно в головном мозге). Обладая липотропным действием, инозит предотвращает ожирение печени при недостатке белка в рационе. Суточная потребность человека в инозите составляет 1—1,5 г (20 мг на 1 кг массы тела)
В организм человека витамин В8 поступает с продуктами растительного (пшеница, пшеничные проростки, апельсины, зеленый горошек, дыня, морковь, персики, капуста — цветная и белокочанная, хлеб, томаты, свекла) и животного происхождения (яйца, сыр, молоко, рыба, мясо — куриное, свинина, телятина, говядина; печень). Витаминная недостаточность у людей не установлена.