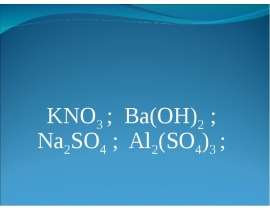
Готовые презентации на тему:
- Образование
- Искусство и Фото
- Наши презентации
- Авто/мото
- Технологии
- Бизнес и предпринимательство
- Карьера
- Данные и аналитика
- Дизайн
- Устройства и комплектующие
- Экономика и Финансы
- Машиностроение
- Развлечения и Юмор
- Путешествия
- Eда
- Политика
- Юриспруденция
- Здоровье и Медицина
- Интернет
- Инвестиции
- Закон
- Стиль жизни
- Маркетинг
- Мобильные технологии
- Новости
- Недвижимость
- Рекрутинг
- Розничная торговля
- Таможня, ВЭД, Логистика
- Наука
- Услуги
- Программное обеспечение
- Спорт
- Музыка
- Шаблоны презентации
- Детские презентации
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- История
- Литература
- Информатика
- Математика
- Обществознание
- Русский язык
- Физика
- Философия
- Химия
- МХК
- ОБЖ
- Окружающий мир
- Педагогика
- Технология
- Начальная школа
- Раскраски для детей
- Товароведение
- Менеджмент
- Страхование




![физические
свойства
Серовато-белый пластичный металл, температуры плавления и кипения — 2041,4 K (1768,3 °C) и 4098 K (3825 °C)[2] соответственно, удельное электрическое сопротивление — 0,098 мкОм·м (при 0 °С). Платина — один из самых тяжёлых (плотность 21,09—21,45 г/см³[2][3]; атомная плотность 6,62·1022 ат/см³) металлов.](/documents_6/3b9d04ea2f0f5d1891660780ec0e12f3/img3.jpg)

![Области
приминения
Осн. области применения платины, ее сплавов и соед.- автомобилестроение (в развитых странах потребляется от 30 до 65% платины), электротехника и электроника (7-13%), нефтехимия и орг. синтез (7-12%), стекольная и керамич. пром-сть (3-17%), произ-во ювелирных изделий (2-35%). Применение катализаторов дожигания выхлопных газов автомобилей [сплав Pt-Pd (70-30%)] началось в сер. 70-х гг. и быстро расширялось в связи с ужесточением требований к охране атм. воздуха. В электротехнике и электронике платину используют как материал контактов электрич. приборов и печей сопротивления. Так, для контактов высоковольтных реле применяют сплавы платины с Ir и Ru. Платина и ее сплавы с Ir и Re в нефтехимии применяют для повышения октанового числа бензина, в орг. синтезе-как катализаторы гидрирования, изомеризации, циклизации, окисления. С помощью таких катализаторов производят, напр., бензол, толуол, ксилол.](/documents_6/3b9d04ea2f0f5d1891660780ec0e12f3/img6.jpg)