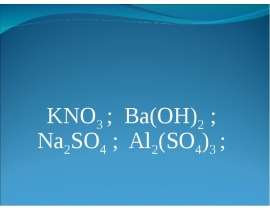
Готовые презентации на тему:
- Образование
- Искусство и Фото
- Наши презентации
- Авто/мото
- Технологии
- Бизнес и предпринимательство
- Карьера
- Данные и аналитика
- Дизайн
- Устройства и комплектующие
- Экономика и Финансы
- Машиностроение
- Развлечения и Юмор
- Путешествия
- Eда
- Политика
- Юриспруденция
- Здоровье и Медицина
- Интернет
- Инвестиции
- Закон
- Стиль жизни
- Маркетинг
- Мобильные технологии
- Новости
- Недвижимость
- Рекрутинг
- Розничная торговля
- Таможня, ВЭД, Логистика
- Наука
- Услуги
- Программное обеспечение
- Спорт
- Музыка
- Шаблоны презентации
- Детские презентации
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- История
- Литература
- Информатика
- Математика
- Обществознание
- Русский язык
- Физика
- Философия
- Химия
- МХК
- ОБЖ
- Окружающий мир
- Педагогика
- Технология
- Начальная школа
- Раскраски для детей
- Товароведение
- Менеджмент
- Страхование






![Результат действия конкурентного ингибирования
на графике зависимости V от [S]](/documents_6/4e83ab1b43cc0ba1265568782d866085/img5.jpg)


![Результат действия неконкурентного ингибитора на графике зависимости [S]](/documents_6/4e83ab1b43cc0ba1265568782d866085/img8.jpg)




![Аллостерическая регуляция
Характерна для олигомерных ферментов (четвертичная структура). В структуре имеются каталитические протомеры( с активным центром) и протомеры - регуляторные ( с аллостерич. центром)
Аллостерические ферменты меняют активность не только от концентрации субстрата , но и под действием эффекторов (результат- изменение конфигурации молекулы и активного центра).
Аллостерические ферменты- регуляторные ферменты метаболических путей, катализируют 1-ю необратимую (самую медленную) реакцию метаболического пути.
Активность остальных ферментов этого пути от [S]
S P 1 P2 P3→ P](/documents_6/4e83ab1b43cc0ba1265568782d866085/img13.jpg)