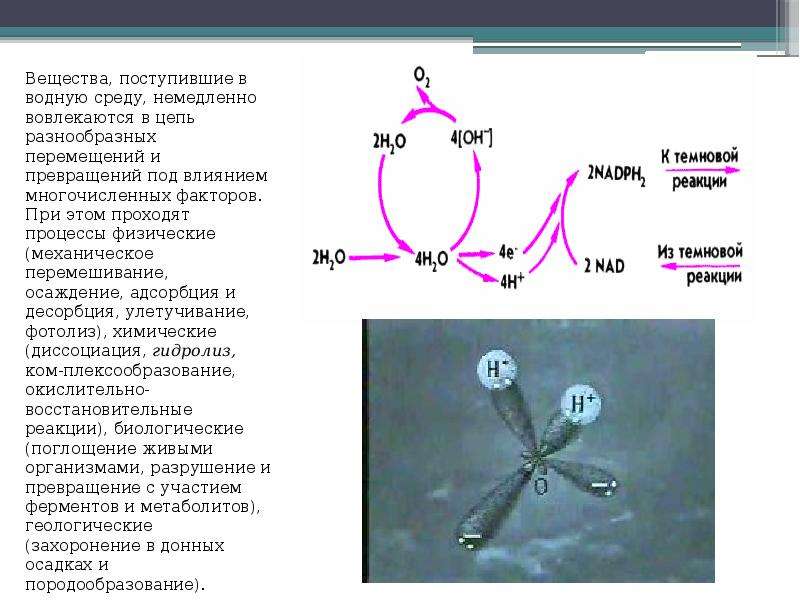
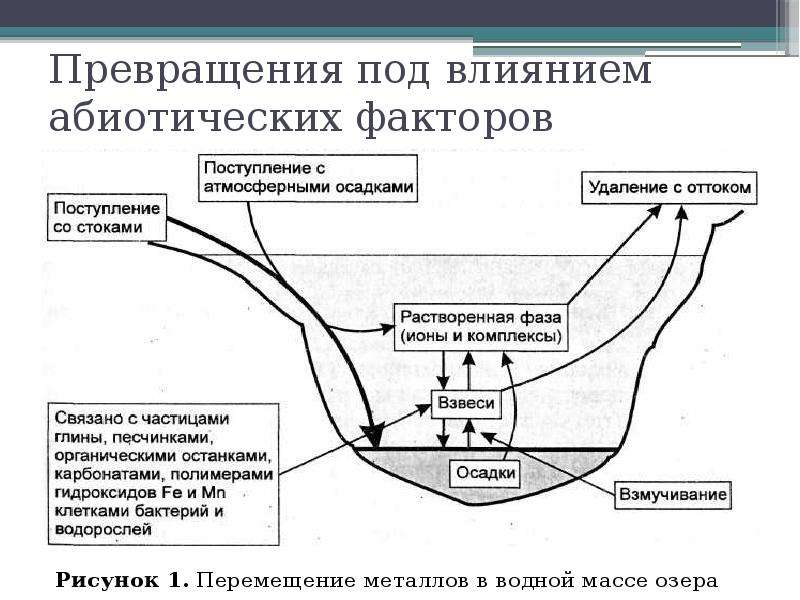
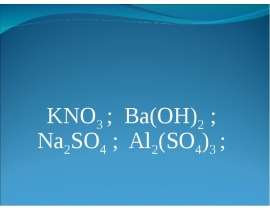
Описание слайда:
Прохождение физических процессов устанавливает некоторое соотношение между растворенной и нерастворенной фракциями вещества. Растворенной фракцией считается все вещество, которое проникает через фильтр с диаметром пор 0,45 мк.
Значительная часть нефти и нефтепродуктов, пестицидов, полих-лорированных бифенилов, ПАВ локализуется в поверхностной пленке, толщиной до десятков микрон. В океанических водах концентрация металлов в этом слое в 10-1 000 раз превышает концентрацию уже в нескольких сантиметрах от поверхности.
Металлы в растворимой фракции могут находиться в виде гидратированных ионов, неорганических и органических соединений и комплексов, в том числе с хелатообразователями, гуминовыми, фульвовыми кислотами, полисахаридами, всегда присутствующими в природных водах. Так, растворимая фракция меди включала ионы Cu(H2O)nХ+, Сu(ОН)4-, Cu(OH)20, Cu(OH)2+, CuC03, Cu(CN)-, CuCl22-, комплексы с гидроксилом и другими ионами, неорганические соединения; органические комплексы с пептидами, порфиринами, гуматами.
Нерастворимая фракция включала медь, адсорбированную мицеллами Fе(ОН)з, взвешенным веществом, клетками водорослей, сестоном, зоопланктоном, CuS, CuO, Cu2(OH)2C03. В результате менее одного процента общей растворившейся меди присутствует в водной среде в виде свободного иона.
Фракция коллоидов включает оксиды и гидроксиды металлов с размером частиц до 150 ммк. Важную роль в адсорбции металлов играют мицеллы гидроокиси железа и гидратированного диоксида марганца. В коллоидной фракции металлов содержится, по крайней мере, на порядок больше, чем в форме свободных ионов. При дефиците кислорода окислительно-восстановительное равновесие сдвигается в направлении возрастания доли восстановленных форм элементов, более растворимых в воде, чем окисленные. Это служит одной из причин повышения концентрации растворенных элементов в водах при недостатке кислорода, особенно — в придонных слоях воды. Вторая причина повышения концентрации элементов при недостатке кислорода может заключаться в распаде коллоидных мицелл оксидов железа и марганца и освобождении адсорбированных на них ионов тяжелых металлов.