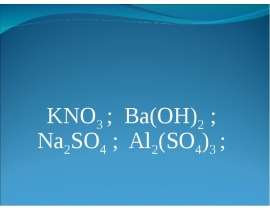
Слайды и текст этой презентации
Слайд 1

Описание слайда:
Деловая игра
Факторы,
влияющие на скорость
химической реакции
Слайд 2

Описание слайда:
Факторы, влияющие на скорость химической реакции
Скорость химических реакций зависит от многих факторов. Основными из них являются:
природа и концентрация реагирующих веществ,
давление (в реакциях с участием газов),
температура,
действие катализаторов,
поверхность реагирующих веществ в случае гетерогенных реакций.
Слайд 3

Описание слайда:
Скорость реакции
Скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени:
υ = ∆ C / ∆ t ( моль/л с )
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности:
υ = ∆ n / ∆t S ( моль/с м2 )
Где S-площадь поверхности соприкосновения веществ ( м2 , см2 )
Слайд 4

Описание слайда:
Зависимость скорости химической реакции от концентрации реагирующих веществ
Зависимость скорости химической реакции от концентрации реагирующих веществ описывается основным законом химической кинетики – законом действующих масс.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
CN2 и CH2 – концентрации азота и водорода (моль/л)
k- коэффициент пропорциональности, называемый константой скорости реакции.
Слайд 5

Описание слайда:
Правило Я.Х. Вант-Гоффа :
Правило Я.Х. Вант - Гоффа :
Повышение температуры на каждые 10 С приводит к увеличению скорости реакции в 2-4 раза (эту величину называют температурным коэффициентом реакции).
Математически эта зависимость выражается соотношением:
υt2 = υt1 γ 10
υt2 , υt1 – скорости реакции соответственно при конечной t2 и начальной t1 температурах , γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры на каждые 10 С.
Слайд 6

Описание слайда:
Катализ
Катализаторами называются вещества, не расходующиеся в результате протекания реакции, но влияющие на её скорость.
Явление изменения скорости реакции под действием таких веществ называется катализом.
Реакции, протекающие под действием катализаторов, называются каталитическими.
В зависимости от агрегатного состояния катализатора и реагирующих веществ различают катализ гомогенный и гетерогенный.
Слайд 7

Описание слайда:
Итог деятельности деловой игры:
-расширены знания о скорости химической реакции и о факторах, влияющих на неё;
-выявлены «болевые точки» в технологической линии по производству аммиака;
-предложены решения с целью предупреждения кризиса на предприятии.
Слайд 8

Описание слайда:
Ведущие специалисты:
Главный инженер – Галкин Вячеслав
Сетевой администратор – Искучеков Александр
Финансовый директор – Вагин Алексей
Технолог 1 – Чусова Алёна
Технолог 2 – Фаллер Анастасия
Технолог 3 – Лузина Ирина
Учащиеся 11 класса Туимской СОШ №3
Презентацию на
тему Факторы, влияющие на скорость химической реакции можно скачать бесплатно ниже: