Слайды и текст этой презентации
Слайд 1

Описание слайда:
Химические свойства и применение алканов
10 класс
Презентацию подготовила учитель химии МОУ «СОШ с. Тёпловка Новобурасского района Саратовской области Давыдова Н.Г.
Слайд 2

Описание слайда:
Цель урока
Образовательная: изучение химических свойств алканов, опираясь на их строение.
Развивающая: продолжить формирование умения составлять уравнения химических реакций, умений анализировать, сравнивать делать собственные выводы.
Воспитательная: воспитание патриотизма на примерах значительных вкладов в химическую науку русских и советских ученых, показать использование алканов и их производных в мирных целях
Слайд 3

Описание слайда:
Изучить важнейшие химические свойства алканов и показать их зависимость от особенностей строения предельных углеводородов.
Изучить важнейшие химические свойства алканов и показать их зависимость от особенностей строения предельных углеводородов.
Совершенствование составления структурных формул гомологов, изомеров, уравнений химических реакций.
Раскрыть важнейшие области практического применения алканов
Слайд 4

Описание слайда:
Горение
Горение
При поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду и выделяя большое количество тепла.
CH4 + 2O2 ––пламя> CO2 + 2H2O
C5H12 + 8O2 ––пламя> 5CO2 + 6H2O
Слайд 5

Описание слайда:
Реакции замещения - это
Реакции замещения - это
реакции алканов, идущих с разрывом С_Н связей.
Слайд 6

Описание слайда:
СН4 + Cl2hv CH3Cl + HCl
Хлорметан, или
Хлористый метил
СН3 Cl – газ, легко сжижается и при последующем испарении поглощает большое количество теплоты. Применяется в холодильных установках
Слайд 7

Описание слайда:
СН3Cl + Cl2 hv CH2Cl2 + HCl
СН3Cl + Cl2 hv CH2Cl2 + HCl
Дихлорметан,
или хлористый
метилен
СН2 Cl2 – применяется как растворитель, для
склеивания
пластиков
Слайд 8

Описание слайда:
СН2Cl2 + Cl2 hv CHCl3 + HCl
СН2Cl2 + Cl2 hv CHCl3 + HCl
Трихлорметан
или хлороформ
СН Cl3 – хлороформ, бесцветная летучая жидкость с эфирным запахом и сладким вкусом используется:
при производстве фреонового хладагента;
в качестве растворителя в фармакологической промышленности;
для производства красителей и пестицидов
Слайд 9

Описание слайда:
СНCl3 + Cl2 hv CCl4 + HCl
СНCl3 + Cl2 hv CCl4 + HCl
Тетрахлорметан,
(четыреххлористый
углерод)
С Cl4 - применяется как растворитель (жиров, смол, каучука);
для получения фреонов, в медицине.
Являлся стандартным наполнителем переносных огнетушителей для советской бронетехники
Слайд 10

Описание слайда:
При нагревании алканов до 140°С
с разбавленной (10%-ной) азотной
кислотой под давлением
осуществляется реакция нитрования –
замещение атома водорода
нитрогруппой (реакция М.И.Коновалова).
СН4 + HO-NO2 = CH3-NO2 + H2O
Слайд 11

Описание слайда:
Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного скелета с образованием алканов разветвленного строения.
Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного скелета с образованием алканов разветвленного строения.
CH3-CH2-CH2-CH3 AlCl3 CH3-CH-CH3
CH3
n-бутан 2-метил пропан
Слайд 12

Описание слайда:
При нагревании до температуры выше 500° в молекулах алканов происходит разрыв связей между атомами углерода.
При нагревании до температуры выше 500° в молекулах алканов происходит разрыв связей между атомами углерода.
C 10H22 C5H12+C5H10
C10H22 C4H10+C6H12
Этот процесс называется термическим крекингом (от англ. tocrack– «колоть, расщеплять»).
Слайд 13

Слайд 14

Описание слайда:
При увеличении температуры можно достичь такой степени протекания реакции, при которой органические вещества – углеводороды – полностью разлагаются на углерод и водород. Такой процесс называется пиролизом.
При увеличении температуры можно достичь такой степени протекания реакции, при которой органические вещества – углеводороды – полностью разлагаются на углерод и водород. Такой процесс называется пиролизом.
СН4 С+2Н2
Слайд 15

Описание слайда:
При пропускании нагретого алкана над платиновым или никелевым катализатором может отщепиться водород. Этот процесс называется дегидрированием
При пропускании нагретого алкана над платиновым или никелевым катализатором может отщепиться водород. Этот процесс называется дегидрированием
C3H8 C3H6 + H2
Слайд 16

Описание слайда:
СН4+Н2O CO+3H2
СН4+Н2O CO+3H2
Так называют взаимодействия алканов, из которых чаще всего используют природный газ с парами воды. При высокой температуре около 1000 образуется смесь оксида углерода – угарного газа и водорода. Эту смесь называют синтез- газ. Часто ее не разделяют, а используют для получения разных органических веществ.
Слайд 17
Описание слайда:
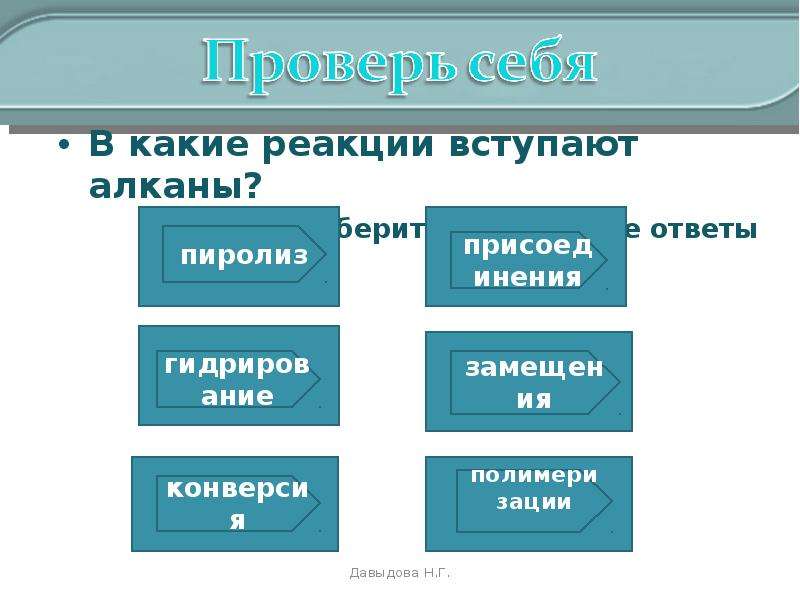
В какие реакции вступают алканы?
В какие реакции вступают алканы?
Выберите правильные ответы
Слайд 18

Описание слайда:
Кто из учёных по словам соотечественников сумел оживить «мертвецов»?
Кто из учёных по словам соотечественников сумел оживить «мертвецов»?
Слайд 19

Описание слайда:
По желанию можно выполнить одно из двух заданий:
По желанию можно выполнить одно из двух заданий:
1. Составить генетическую цепь, используя полученные знания по химическим свойствам (3-4 звена).
2. Какой из галогензамещённых алканов применяли как анестезирующее средство? (используя справочную литературу подготовить сообщение)
Слайд 20

Описание слайда:
Использованные источники
http://school-collection.edu.ru/catalog/res/76f609e3-5da6-7559-4264-68d3548bb069/view/
http://files.school-collection.edu.ru/dlrstore/8d7caa13-f7f5-c3db-3f7d-a504e7456d96/00119627250504103.htm
http://files.school-collection.edu.ru/dlrstore/5838e73f-fd71-188f-d53c-b3903cc3a965/00119627348768537.htm
http://school-collection.edu.ru/catalog/res/5e8f612a-b762-9f6b-de63-c5dc1d3e64c5/view/
http://school-collection.edu.ru/catalog/res/47cbac0d-2c6b-46bc-d57f-4b250cfa0e07/view/
htthttp://school-collection.edu.ru/catalog/res/47cbac0d-2c6b-46bc-d57f-4b250cfa0e07/view/
p://www.youtube.com/watch?v=CnJnT9tXzaQ
http://www.youtube.com/watch?v=CnJnT9tXzaQ
Презентацию на
тему Химические свойства и применение алканов можно скачать бесплатно ниже: