Описание слайда:
Закон Гей - Люссака
В 1808 Гей-Люссак открыл закон объёмных отношений, согласно которому объемы газов, вступающих в реакцию, относятся друг к другу и к объемам газообразных продуктов реакции как целые числа. В том же году Гей-Люссак и Л. Тенар разработали способ получения калия и натрия сильным нагреванием едкого калия или едкого натрия с железными стружками; нагреванием борного ангидрида с калием выделили свободный (нечистый) бор. Они же доказали элементарную природу хлора, калия и натрия. В 1813-14 Гей-Люссак одновременно с Г. Деви показал, что йод - химический элемент, очень похожий на хлор, и получил соединения йода, в частности йодистый водород. Приготовив чистую синильную кислоту (1811), Гей-Люссак признал её водородным соединением сложного радикала циана. Нагреванием цианистой ртути он получил циан (дициан). К этому времени было установлено существование бескислородных кислот, которые Гей-Люссак предложил называть водородными кислотами. Одновременно с И. Берцелиусом и И. Дерберейнером усовершенствовал органический элементарный анализ, применив окись меди для сжигания органических веществ. В 1819 Гей-Люссак построил на основании своих определений первые диаграммы растворимости солей в воде и подметил существование двух отдельных кривых растворимости для безводного сульфата натрия и его десятиводного гидрата. В 1827 Гей-Люссак изобрёл башню для улавливания окислов азота, выходящих из свинцовых камер при производстве серной кислоты. Башни, носящие его имя, впервые применены в
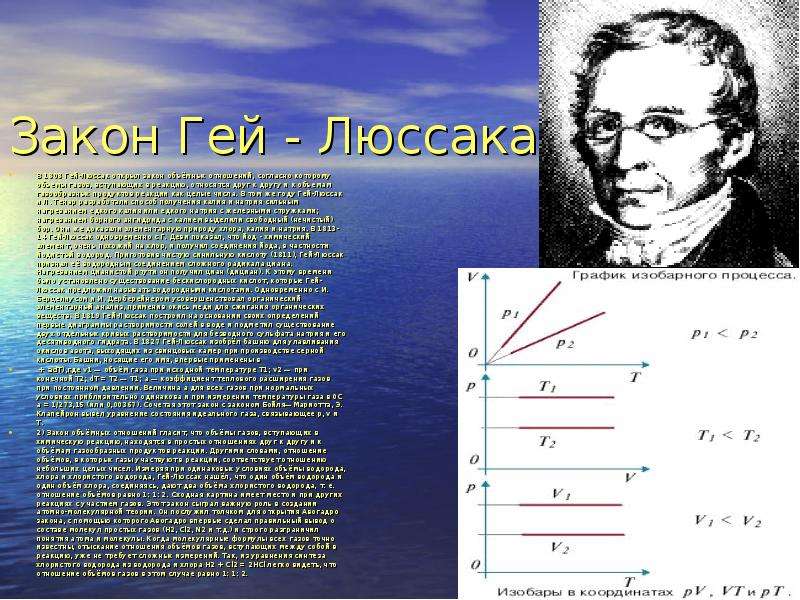
+ adT),где v1 — объём газа при исходной температуре T1; v2 — при конечной T2; dT = T2 — T1; a — коэффициент теплового расширения газов при постоянном давлении. Величина a для всех газов при нормальных условиях приблизительно одинакова и при измерении температуры газа в 0С a = 1/273,15 (или 0,00367). Сочетая этот закон с законом Бойля—Мариотта, Э. Клапейрон вывел уравнение состояния идеального газа, связывающее р, v и Т.
2) Закон объёмных отношений гласит, что объёмы газов, вступающих в химическую реакцию, находятся в простых отношениях друг к другу и к объёмам газообразных продуктов реакции. Другими словами, отношение объёмов, в которых газы участвуют в реакции, соответствует отношению небольших целых чисел. Измеряя при одинаковых условиях объёмы водорода, хлора и хлористого водорода, Гей-Люссак нашёл, что один объём водорода и один объём хлора, соединяясь, дают два объёма хлористого водорода, т. е. отношение объёмов равно 1: 1: 2. Сходная картина имеет место и при других реакциях с участием газов. Этот закон сыграл важную роль в создании атомно-молекулярной теории. Он послужил толчком для открытия Авогадро закона, с помощью которого Авогадро впервые сделал правильный вывод о составе молекул простых газов (H2, Cl2, N2 и т.д.) и строго разграничил понятия атома и молекулы. Когда молекулярные формулы всех газов точно известны, отыскание отношения объёмов газов, вступающих между собой в реакцию, уже не требует сложных измерений. Так, из уравнения синтеза хлористого водорода из водорода и хлора Н2 + Cl2 = 2HCl легко видеть, что отношение объёмов газов в этом случае равно 1: 1: 2.