Готовые презентации на тему:
- Образование
- Искусство и Фото
- Наши презентации
- Авто/мото
- Технологии
- Бизнес и предпринимательство
- Карьера
- Данные и аналитика
- Дизайн
- Устройства и комплектующие
- Экономика и Финансы
- Машиностроение
- Развлечения и Юмор
- Путешествия
- Eда
- Политика
- Юриспруденция
- Здоровье и Медицина
- Интернет
- Инвестиции
- Закон
- Стиль жизни
- Маркетинг
- Мобильные технологии
- Новости
- Недвижимость
- Рекрутинг
- Розничная торговля
- Таможня, ВЭД, Логистика
- Наука
- Услуги
- Программное обеспечение
- Спорт
- Музыка
- Шаблоны презентации
- Детские презентации
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- История
- Литература
- Информатика
- Математика
- Обществознание
- Русский язык
- Физика
- Философия
- Химия
- МХК
- ОБЖ
- Окружающий мир
- Педагогика
- Технология
- Начальная школа
- Раскраски для детей
- Товароведение
- Менеджмент
- Страхование




![Молекула фтора F2 имеет относительно небольшую массу и достаточно подвижна, поэтому фтор в обычных условиях — газ (светло-желтого цвета), обладает низкой температурой плавления (—223 °С) и кипения (—187 oС).
Молекула фтора F2 имеет относительно небольшую массу и достаточно подвижна, поэтому фтор в обычных условиях — газ (светло-желтого цвета), обладает низкой температурой плавления (—223 °С) и кипения (—187 oС).
Из-за высокой окислительной активности фтора и большой прочности его соединений фтор получают в свободном состоянии электролизом его расплавленных соединений. Для этих целей обычно используют эвтектическую смесь НF – КF или фторогидрогенаты калия (например K[HF2] - дифторогидрогенат калия).
Фтор и его соединения сильно ядовиты (исключение составляют CF4, SF6 - элегаз и некоторые другие вещества).](/documents/a4cb915fc659dd8e3df6f458703fd1a9/img3.jpg)





![Фтор окисляет некоторые так называемые инертные газы: (при нормальном Р)
Фтор окисляет некоторые так называемые инертные газы: (при нормальном Р)
Хе + 2F2 = ХеF4(к), Нo298 = – 252 кДж/моль;
Хе + 3F2 = ХеF6(к) (при повышенном Р = 6МПа)
Хе + F2 = ХеF2(к) (электр. разр., УФ-излучение)
2ХеF2 = Хе + ХеF4; 3ХеF4 = Хе + 2ХеF6.
ХеF6 + H2O = ХеOF4(ж) + 2HF;
ХеOF4 +2H2O = ХеO3(т) + 4HF
Xe + PtF6 = Xe+[PtF6]-.
Непосредственно фтор не взаимодействует лишь с гелием, неоном и аргоном.](/documents/a4cb915fc659dd8e3df6f458703fd1a9/img9.jpg)
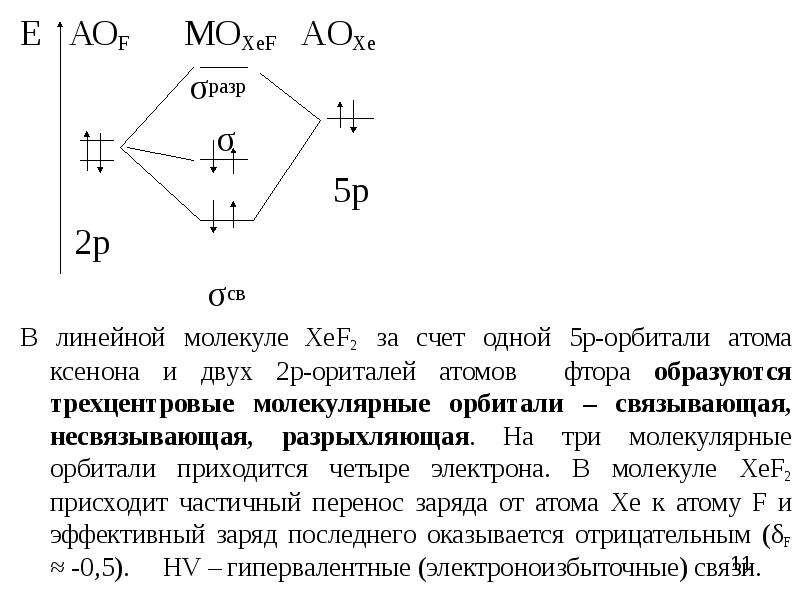
![В соответствии с закономерным изменением характера элементов по периодам и группам периодической системы закономерно изменяются и свойства фторидов, например:
В соответствии с закономерным изменением характера элементов по периодам и группам периодической системы закономерно изменяются и свойства фторидов, например:
Химическая природа
NaF, MgF2 основная
AlF3 амфотерная
AlF63-
SiF4, PF5, SF6, (ClF5) кислотная
SiF62-, PF6-, SF60, (ClF6-)
Известно много прочных комплексов ([BF4]-, [BeF4]2-,
[SiF6]2-, [AlF6]3- и др.). WF6>ReF6> OsF6>IrF6>PtF6](/documents/a4cb915fc659dd8e3df6f458703fd1a9/img11.jpg)


![По химической природе ионные фториды являются основными соединениями, а ковалентные фториды — кислотными. Так в реакции
По химической природе ионные фториды являются основными соединениями, а ковалентные фториды — кислотными. Так в реакции
2NаF + SiF4 = Nа2[SiF6]
основный кислотный гексафторосиликат натрия
ионный NаF выступает в качестве донора, а ковалентный SiF4 — в качестве акцептора электронных пар, носителем которых является фторид-ион F-.](/documents/a4cb915fc659dd8e3df6f458703fd1a9/img14.jpg)
![Основные фториды при гидролизе создают щелочную среду, а кислотные фториды — кислотную
Основные фториды при гидролизе создают щелочную среду, а кислотные фториды — кислотную
NaF + H2O = NaOH + HF
SiF4 + 3Н2O = Н2SiО3 + 4НF
Амфотерные фториды взаимодействуют как с основными, так и с кислотными фторидами. В последнем случае образуются смешанные фториды, например:
2КF + ВеF2= К2[ВеF4]
(ВеF2 как кислотное соединение)
ВеF2 + SiF4 = Be[SiF6]
(ВеF2 как основное соединение)](/documents/a4cb915fc659dd8e3df6f458703fd1a9/img15.jpg)

![Комплексные фториды весьма разнообразны. Координационное число по фтору для элементов 2-го периода равно 4, для элементов других периодов типичное координационное число 6. Кроме того, встречаются комплексные фториды, в которых координационное число комплексообразователя равно 7, 8 и 9, например:
Комплексные фториды весьма разнообразны. Координационное число по фтору для элементов 2-го периода равно 4, для элементов других периодов типичное координационное число 6. Кроме того, встречаются комплексные фториды, в которых координационное число комплексообразователя равно 7, 8 и 9, например:
К2[ВеF4] К3[А1F6] К2[NbF7] К2[ReF9]
Эти же примеры показывают, что во фторокомплексах стабилизируется. высшая степень окисления центральных атомов.
Производные фторокомплексов представляют собой преимущественно ионые соединения либо относятся к смешанным (полимерным) фторидам (например, ВеSiF6).
Соединения с водородом типа НВF4, НРF6, Н2SiF6 в свободном состоянии неустойчивы. Их водные растворы — очень сильные кислоты (типа HClO4).](/documents/a4cb915fc659dd8e3df6f458703fd1a9/img17.jpg)


![Собственная ионизация жидкого НF незначительна (К = 2,0710-11). Она происходит путем перехода протона (или соответственно иона фтора) от одной молекулы к другой, сопровождающегося превращением водородной связи из межмолекулярной в межатомную и в ковалентную. При этом образуются сольватированные фтороний-ион FH2+ и фторогидрогенат-ион НF2- по схеме
Собственная ионизация жидкого НF незначительна (К = 2,0710-11). Она происходит путем перехода протона (или соответственно иона фтора) от одной молекулы к другой, сопровождающегося превращением водородной связи из межмолекулярной в межатомную и в ковалентную. При этом образуются сольватированные фтороний-ион FH2+ и фторогидрогенат-ион НF2- по схеме
Н—FН—FН—F [H—F—H]+ + [F—Н—F]-](/documents/a4cb915fc659dd8e3df6f458703fd1a9/img20.jpg)




![HF неограниченно растворяется в воде. HF ионизируется с образованием ионов OH3+ и F-.
HF неограниченно растворяется в воде. HF ионизируется с образованием ионов OH3+ и F-.
Последние взаимодействуя с HF, образуют фторогидрогенат-ионы: 2HF +Н2О = OH3+ +НF2-.
Раствор НF (плавиковая кислота) (фтороводородная = фтористоводородная) является кислотой средней силы (К=6,210-4). В растворе содержатся также комплексные ионы Н2F3-, Н3F4-, НnFn+1-. Поэтому при нейтрализации растворов плавиковой кислоты образуются не фториды, а фторогидрогенаты типа К[НF2].](/documents/a4cb915fc659dd8e3df6f458703fd1a9/img25.jpg)
![При нейтрализации HF образуются фторогидрогенаты
При нейтрализации HF образуются фторогидрогенаты
2HF + KOH = K[HF2] + H2O
КНF2, КH2F3, КH3F4, КH4F5
Тпл соответственно 239, 62, 66, 72 оС
Эти соединения, как правило, хорошо кристаллизуются и плавятся без разложения Полимерные гидрогенат-ионы имеют зигзагообразную форму. Они образованы за счет водородной связи.](/documents/a4cb915fc659dd8e3df6f458703fd1a9/img26.jpg)
![Термическое разложение фторогидрогенатов используется для получения чистого НF и фторида металла:
Термическое разложение фторогидрогенатов используется для получения чистого НF и фторида металла:
KHF2 = KF + HF
К [НnFn+1] = К [Нn-1Fn] + НF](/documents/a4cb915fc659dd8e3df6f458703fd1a9/img27.jpg)