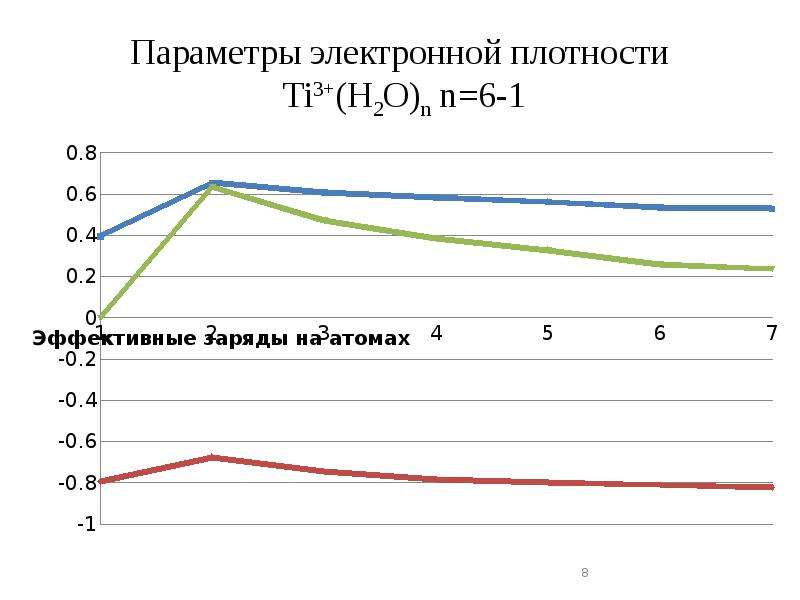
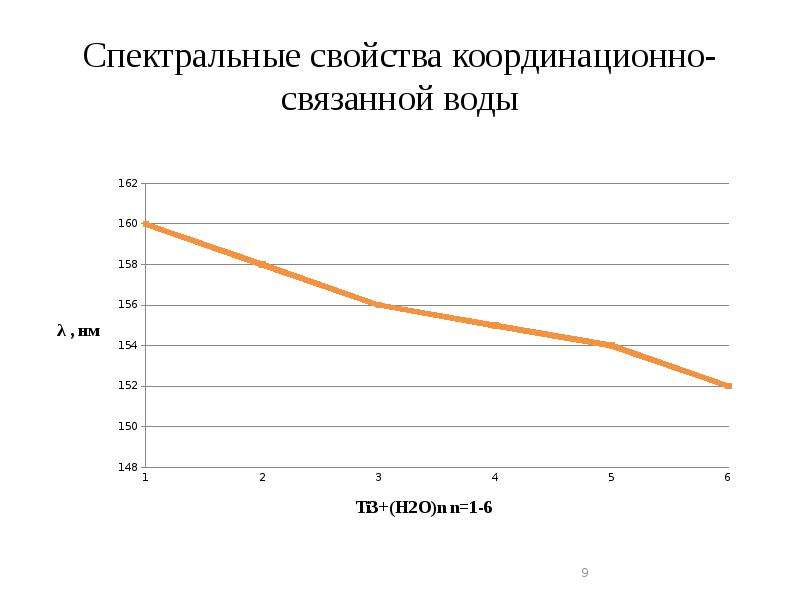
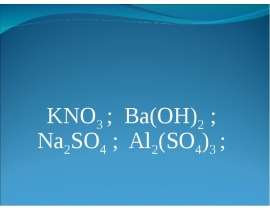
Описание слайда:
14. Wolfram K., Max C.H. A Chemist`s Guide to Density Functional Theory. Second Edition. N.Y.: Wiley, 2001. 293p
15. Schmidt M.W., Baldridge K.K., Boatz J.A., Elbert S.T., Gordon M.S., Jensen J.H., Koscki S., Matsunaga N., Nguyen K.A., Su S.J., Windus T.L., Dupuis M., Montgomery J.A. General atomic and molecular electronic structure system // J. Сomput. Сhem.. 1993. V. 14. № 11. P. 1347-1363.
16. Krishnan R., Binkley J.S., Seeger R., Pople J.A. Self сonsistent molecular orbital methods. XX. A basis set for correlated wave functions // J. Chem. Phys. 1980. V. 72. N 1. P. 650654.
17. Картмелл.Э., Фоулс.Г.В.А. Валентность и строение молекул. М.: Химия, 1978. 320с.
18. Bandura A.V., Kubicki.J.D. Derivation of Force Field Parameters for TiO2-H2O Systems from ab Initio Calculations // J. Phys. Chem. 2003. V. 107. P. 11072-11081.
19. Rimeh D., Patric D., Didier R. Modified TiO2 For Environmental Photocatalytic Applications: а Review. // Chem.Res., 2013. V. 52 (10). P.3581-3599.
20. Wolfram K., Max C.H. A Chemist`s Guide to Density Functional Theory. Second Edition. N.Y.: Wiley, 2001. 293p.
21. Kazuhiko Maeda. Z-Scheme Water Splitting Using Two Different Semiconductor Photocatalysts //ACS Catal., 2013. V. 3(7). P. 1486-1503.
22. Bernd Kallies, Roland Meier. Electronic Structure of 3d [M(H2O)6]3+ Ions from
ScIII to FeIII: A Quantum Mechanical Study Based on DFT Computations and Natural Bond Orbital Analyses // Inorg. Chem., 2001. V. 40. P. 3101-3112
23. Piotr A. Pieniazek., Eric J. Sundstrom, Stephen E. Bradforth., Anna I. Krylova. Degree of Initial Hole Localization/Delocalization in Ionized Water Clusters // J. Phys. Chem., 2009. V. 113. P. 4423-4429.
24. Alexander S. Novikov., Maxim L. Kuznetsov., Armando J. L. Pombeiro., Nadezhda A. Bokach., Georgiry B. Shul`pin. Generation of HO* Radical from Hydrogen Peroxide Catalyzed by Aqua Complexes of the Group III Metals [M(H2O)n]3+ (M = Ga, In, Sc, Y. or La): A Theoretical Study. // ACS Catal., 2013. V.3(6).P. 1195-1208
14. Wolfram K., Max C.H. A Chemist`s Guide to Density Functional Theory. Second Edition. N.Y.: Wiley, 2001. 293p
15. Schmidt M.W., Baldridge K.K., Boatz J.A., Elbert S.T., Gordon M.S., Jensen J.H., Koscki S., Matsunaga N., Nguyen K.A., Su S.J., Windus T.L., Dupuis M., Montgomery J.A. General atomic and molecular electronic structure system // J. Сomput. Сhem.. 1993. V. 14. № 11. P. 1347-1363.
16. Krishnan R., Binkley J.S., Seeger R., Pople J.A. Self сonsistent molecular orbital methods. XX. A basis set for correlated wave functions // J. Chem. Phys. 1980. V. 72. N 1. P. 650654.
17. Картмелл.Э., Фоулс.Г.В.А. Валентность и строение молекул. М.: Химия, 1978. 320с.
18. Bandura A.V., Kubicki.J.D. Derivation of Force Field Parameters for TiO2-H2O Systems from ab Initio Calculations // J. Phys. Chem. 2003. V. 107. P. 11072-11081.
19. Rimeh D., Patric D., Didier R. Modified TiO2 For Environmental Photocatalytic Applications: а Review. // Chem.Res., 2013. V. 52 (10). P.3581-3599.
20. Wolfram K., Max C.H. A Chemist`s Guide to Density Functional Theory. Second Edition. N.Y.: Wiley, 2001. 293p.
21. Kazuhiko Maeda. Z-Scheme Water Splitting Using Two Different Semiconductor Photocatalysts //ACS Catal., 2013. V. 3(7). P. 1486-1503.
22. Bernd Kallies, Roland Meier. Electronic Structure of 3d [M(H2O)6]3+ Ions from
ScIII to FeIII: A Quantum Mechanical Study Based on DFT Computations and Natural Bond Orbital Analyses // Inorg. Chem., 2001. V. 40. P. 3101-3112
23. Piotr A. Pieniazek., Eric J. Sundstrom, Stephen E. Bradforth., Anna I. Krylova. Degree of Initial Hole Localization/Delocalization in Ionized Water Clusters // J. Phys. Chem., 2009. V. 113. P. 4423-4429.
24. Alexander S. Novikov., Maxim L. Kuznetsov., Armando J. L. Pombeiro., Nadezhda A. Bokach., Georgiry B. Shul`pin. Generation of HO* Radical from Hydrogen Peroxide Catalyzed by Aqua Complexes of the Group III Metals [M(H2O)n]3+ (M = Ga, In, Sc, Y. or La): A Theoretical Study. // ACS Catal., 2013. V.3(6).P. 1195-1208