Описание слайда:
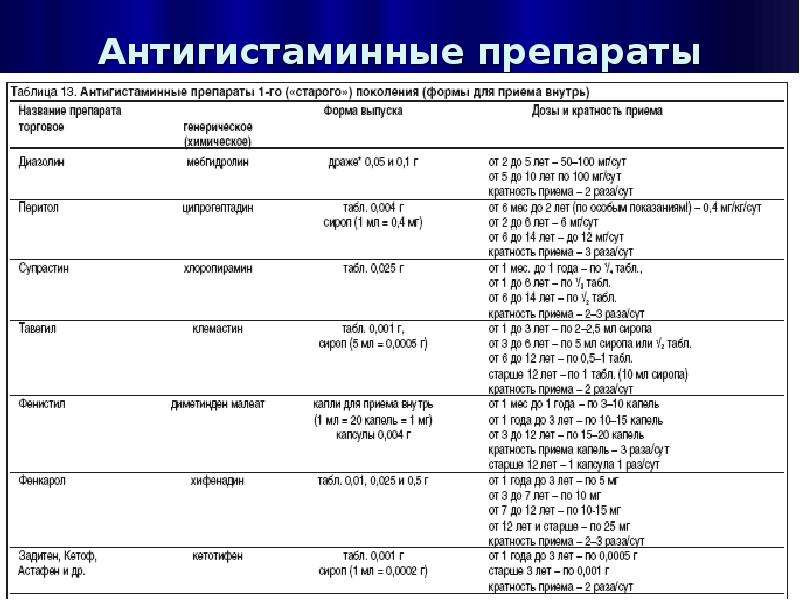
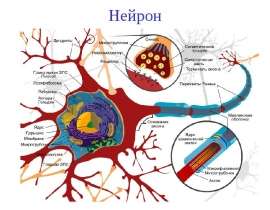
В основе патогенеза АД лежат иммунные механизмы с ведущей ролью Т–лимфоцитов и клеток Лангерганса. Причем клетки Лангерганса являются основными клетками, ответственными за IgE–опосредованное накопление аллергенов в коже и их презентацию Т–лимфоцитам. При антигенном контакте идет определенный обмен внутри клеток Лангерганса. Антиген связывается с высокоаффинными рецепторами IgE, которые расположены на поверхности клеток Лангерганса, в них аллергены подвергаются ферментативному расщеплению. Образующийся при этом полипептид специфически распознается Т–клеточным рецептором CD4+ лимфоцитов. Получив информацию, клетки Лангерганса перемещаются в лимфатические узлы, где вступают во взаимодействие с Th0–лимфоцитами, что способствует активации Т–лимфоцитов–хелперов и усилению дифференцировки их в сторону Th2. Это сопровождается выделением цитокинов. При этом Th2–хелперы продуцируют интерлейкины (ИЛ) – ИЛ–4, ИЛ–5, ИЛ–10, ИЛ–13 и активируют В–лимфоциты с локальной гиперпродукцией специфических IgE.При повторном поступлении аллергена происходит дегрануляция тучных клеток с выделением медиаторов воспаления и хемотаксических агентов, которые запускают раннюю фазу аллергической реакции, клинически проявляющуюся выраженным зудом, гиперемией, отеком. Под действием ИЛ–5, ИЛ–6, ИЛ–8 происходит усиление миграции эозинофилов и макрофагов в воспалительный очаг, что определяет темпы хронизации аллергического воспаления кожи. Причем в хронизации АД особое значение имеют эозинофилы–долгожители, продуцируют высокие уровни основного белка эозинофилов, а также обеспечивают активацию Th1–хелперов с
В основе патогенеза АД лежат иммунные механизмы с ведущей ролью Т–лимфоцитов и клеток Лангерганса. Причем клетки Лангерганса являются основными клетками, ответственными за IgE–опосредованное накопление аллергенов в коже и их презентацию Т–лимфоцитам. При антигенном контакте идет определенный обмен внутри клеток Лангерганса. Антиген связывается с высокоаффинными рецепторами IgE, которые расположены на поверхности клеток Лангерганса, в них аллергены подвергаются ферментативному расщеплению. Образующийся при этом полипептид специфически распознается Т–клеточным рецептором CD4+ лимфоцитов. Получив информацию, клетки Лангерганса перемещаются в лимфатические узлы, где вступают во взаимодействие с Th0–лимфоцитами, что способствует активации Т–лимфоцитов–хелперов и усилению дифференцировки их в сторону Th2. Это сопровождается выделением цитокинов. При этом Th2–хелперы продуцируют интерлейкины (ИЛ) – ИЛ–4, ИЛ–5, ИЛ–10, ИЛ–13 и активируют В–лимфоциты с локальной гиперпродукцией специфических IgE.При повторном поступлении аллергена происходит дегрануляция тучных клеток с выделением медиаторов воспаления и хемотаксических агентов, которые запускают раннюю фазу аллергической реакции, клинически проявляющуюся выраженным зудом, гиперемией, отеком. Под действием ИЛ–5, ИЛ–6, ИЛ–8 происходит усиление миграции эозинофилов и макрофагов в воспалительный очаг, что определяет темпы хронизации аллергического воспаления кожи. Причем в хронизации АД особое значение имеют эозинофилы–долгожители, продуцируют высокие уровни основного белка эозинофилов, а также обеспечивают активацию Th1–хелперов с
преимущественной продукцией интерферона–гамма (ИФН–g). Этот процесс «переключения» Th2–клеток на Th1 связан с повышенной продукцией ИЛ–12, что способствует хронизации аллергического процесса в коже.