Слайды и текст этой презентации
Слайд 1

Описание слайда:
Проект на тему: «Углекислый газ»
Выполнили ученики 11 «А» класса
МБОУ «Школы» №31
Рытикова Алеся, Харахашян Матеос, Хилько Екатерина, Шония Давид, Бицуля Григорий
Слайд 2

Описание слайда:
I. Строение молекул углекислого газа
Слайд 3

Описание слайда:
II.Открытие углекислого газа.
Углекислый газ был первым между всеми другими газами противопоставлен воздуху под названием «дикий газ» алхимиком XVI века Вант Гельмонтом.
Открытием СО2 было положено начало новой отрасли химии – пневматохимии (химии газов).
Шотландский химик Джозеф Блэк (1728–1799) в 1754 году установил, что известковый минерал мрамор (карбонат кальция) при нагревании разлагается с выделением газа и образует негашеную известь (оксид кальция):
CaCO3CaO + CO2
Выделяющийся газ можно было вновь соединить с оксидом кальция и вновь получить карбонат кальция:
CaO + CO2CaCO3
Этот газ был идентичен открытому Ван Гельмонтом «дикому газу», но Блэк дал ему новое название – «связанный воздух» – так как этот газ можно было связать и вновь получить твердую субстанцию – карбонат кальция.
Несколько лет спустя Кавендиш обнаружил еще два характерных физических свойства углекислого газа – его высокую плотность и значительную растворимость в воде.
Слайд 4

Описание слайда:
III. Физические свойства
Оксид углерода (IV) – углекислый газ, газ без цвета и запаха, тяжелее воздуха, растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда» . При атмосферном давлении он не плавится, а испаряется, температура сублимации -78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15 °С) .
Слайд 5

Описание слайда:
IV. Получение углекислого газа
Получение углекислого газа в промышленности:
Оксид углерода 2 горит в кислороде и на воздухе с выделением большого количества теплоты:
2СО+О2=2СО2
Таким же способом углекислый газ можно получать и в лаборатории.
Оксид углерода 2 является сильным восстановителем, поэтому в промышленности его используют для восстановления железных руд:
Fe2O3+3CO=2Fe+3CO2
В промышленности оксид углерода 4 получают при сжигании угля или при прокаливании известняка:
СаСО3=СаО+СО2
Получение углекислого газа в лаборатории:
В лаборатории СО2 получают действием кислот на соли угольной кислоты Н2СО3:
Na2CO3+H2SO4=Na2SO4+CO2+H2O
При действии кислот на карбонаты и их растворы происходит выделение диоксида углерода, вызывающего вспенивание раствора:
СаСО3+НCl=CaCl2+CO2+H2O
Слайд 6
Описание слайда:
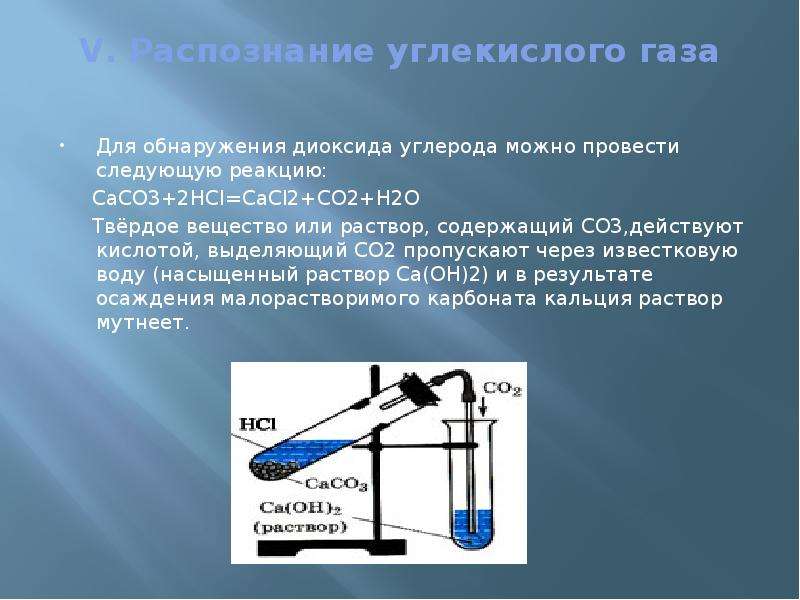
V. Распознание углекислого газа
Для обнаружения диоксида углерода можно провести следующую реакцию:
СаСО3+2HCl=CaCl2+CO2+H2O
Твёрдое вещество или раствор, содержащий СО3,действуют кислотой, выделяющий СО2 пропускают через известковую воду (насыщенный раствор Са(ОН)2) и в результате осаждения малорастворимого карбоната кальция раствор мутнеет.
Слайд 7

Описание слайда:
VI. Применение углекислого газа
Углекислый газ применяют во многих отраслях.
Например:
1.Химическая отрасль;
2.Фармацевтика;
3.Пищевая отрасль;
4.Медицина;
5.Металлургическая отрасль;
6.Лабораторные исследования и анализ;
7.Целлюлозно-бумажная отрасль;
8.Электроника;
9.Охрана окружающей среды.
Слайд 8

Описание слайда:
VII. Нахождение в природе
VII. Нахождение в природе
Содержание углекислого газа в атмосфере относительно небольшое, около 0,03% (по объему). Углекислый газ, сосредоточенный в атмосфере, имеет массу 2200 биллионов тонн.
В 60 раз больше углекислого газа содержится в растворенном виде в морях и океанах.
В течение каждого года из атмосферы извлекается примерно 1/50 часть всего содержащегося в ней CO2 растительным покровом земного шара в процессе фотосинтеза, превращающего минеральные вещества в органические.
Основная масса углекислого газа в природе образуется в результате различных процессов разложения органических веществ. Углекислый газ выделяется при дыхании растений, животных, микроорганизмов. Непрерывно увеличивается количество углекислого газа, выделяемого различными производствами. Углекислый газ содержится в составе вулканических газов, выделяется он и из земли в вулканических местностях.
Вне земного шара оксид углерода (IV) обнаружен в атмосферах Марса и Венеры – планетах «земного типа».
Слайд 9

Описание слайда:
Спасибо за внимание!
Презентацию на
тему Углекислый газ можно скачать бесплатно ниже: