Описание слайда:
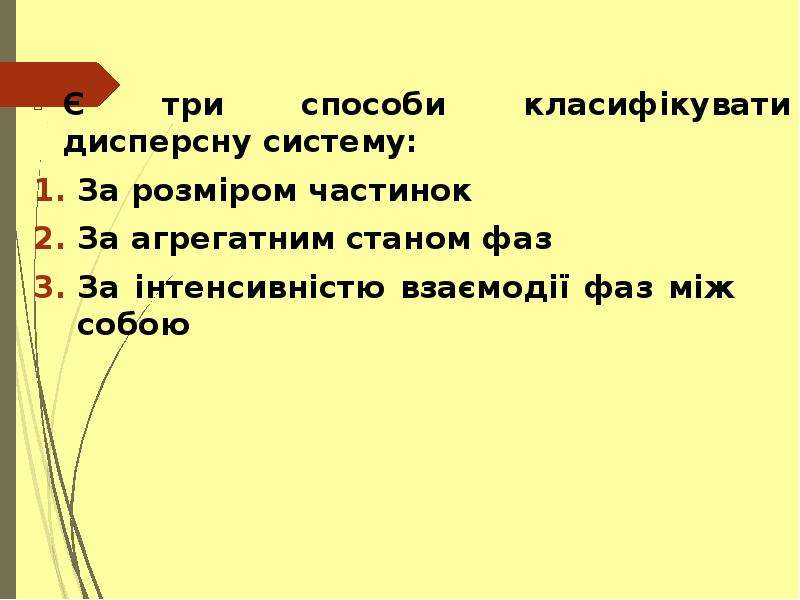
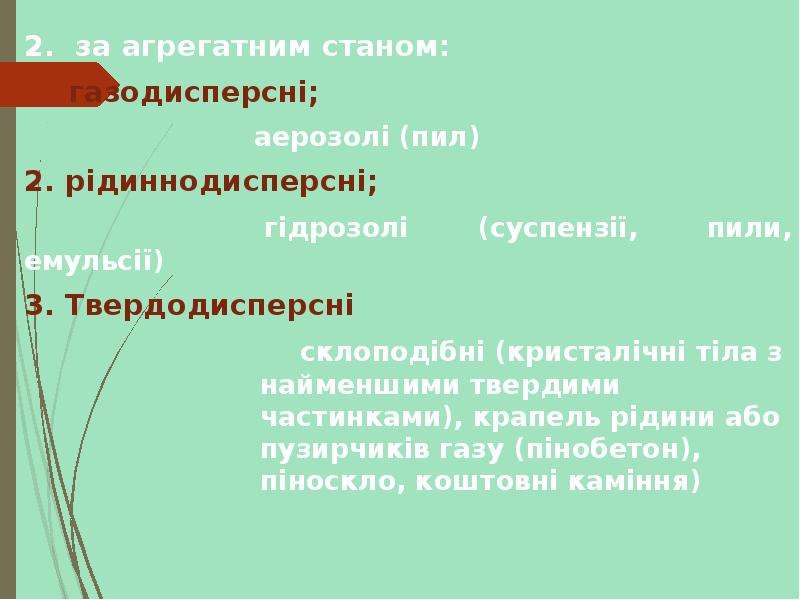
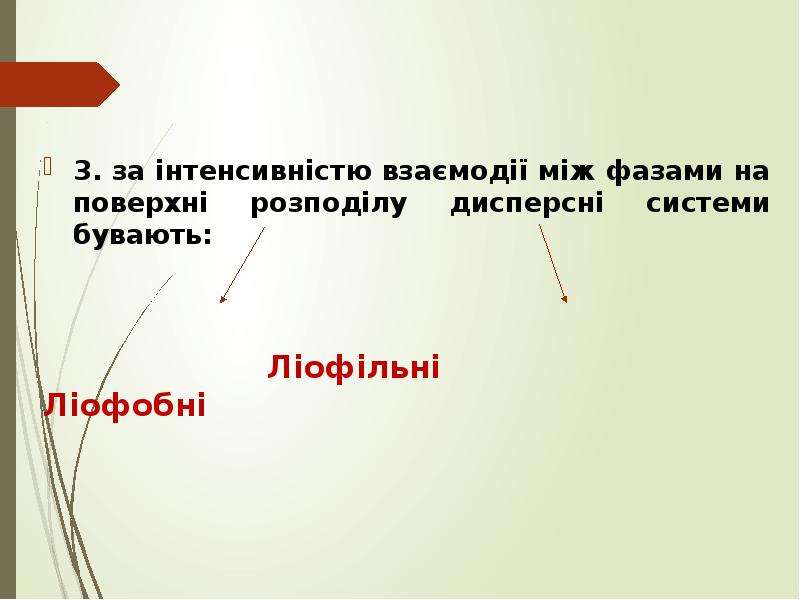
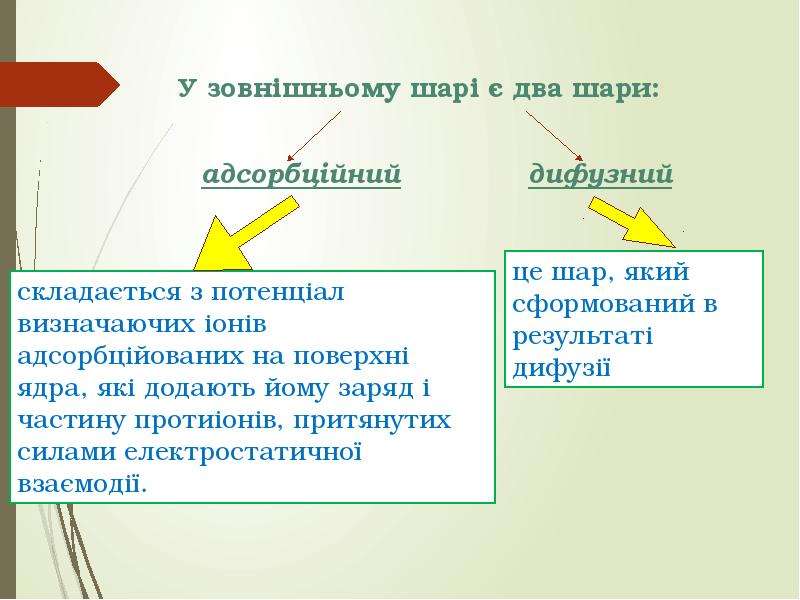
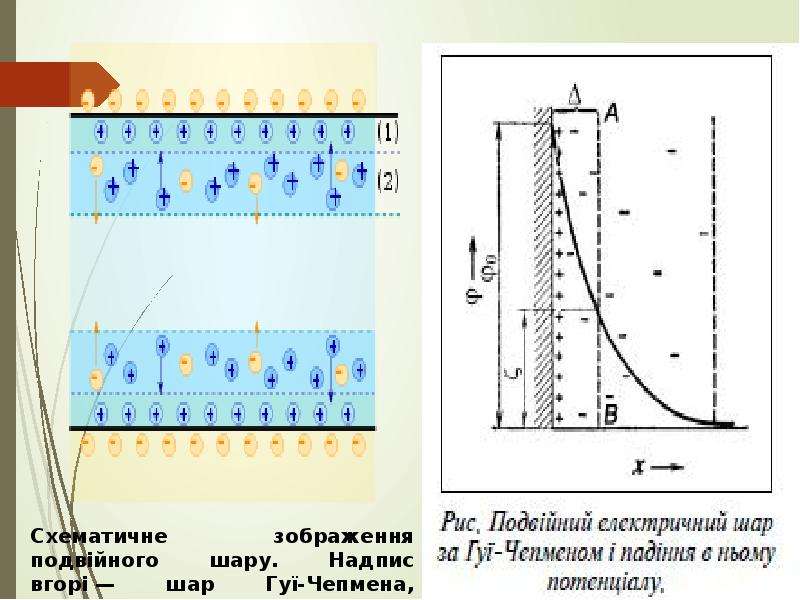
Колоїдні системи — мікрогетерогенні дисперсні системи (проміжний стан між справжніми розчинами й грубо-дисперсними системами), що складаються з дуже подрібнених частинок (від 1 до 1000 нм), рівномірно розподілених (розосереджених) в однорідному середовищі або фізично однорідні системи, що містять макромолекули як один з компонентів (молекулярний колоїд). На відміну від частинок грубодисперсних систем (суспензій, емульсій, пін тощо), розмір частинок яких звичайно перевищує 10−4 см, колоїдні частинки беруть участь в інтенсивному броунівському рухові і не седиментують в полі сил земного тяжіння. Колоїдні системи з газовим дисперсійним середовищем — високодисперсні аерозолі (дими, тумани), з рідким — золі, латекси, міцелярні розчини, мікроемульсії, з твердого — системи типу рубінового скла. Колоїдні системи утворюються внаслідок конденсації (при виділенні колоїдно-дисперсної фази з перенасиченої пари, розчину або розплаву) або диспергування. Найпоширеніші в природі та техніці колоїдні системи з рідким дисперсійним середовищем.
Колоїдні системи — мікрогетерогенні дисперсні системи (проміжний стан між справжніми розчинами й грубо-дисперсними системами), що складаються з дуже подрібнених частинок (від 1 до 1000 нм), рівномірно розподілених (розосереджених) в однорідному середовищі або фізично однорідні системи, що містять макромолекули як один з компонентів (молекулярний колоїд). На відміну від частинок грубодисперсних систем (суспензій, емульсій, пін тощо), розмір частинок яких звичайно перевищує 10−4 см, колоїдні частинки беруть участь в інтенсивному броунівському рухові і не седиментують в полі сил земного тяжіння. Колоїдні системи з газовим дисперсійним середовищем — високодисперсні аерозолі (дими, тумани), з рідким — золі, латекси, міцелярні розчини, мікроемульсії, з твердого — системи типу рубінового скла. Колоїдні системи утворюються внаслідок конденсації (при виділенні колоїдно-дисперсної фази з перенасиченої пари, розчину або розплаву) або диспергування. Найпоширеніші в природі та техніці колоїдні системи з рідким дисперсійним середовищем.